题目内容
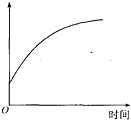 某课外兴趣小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图的函数图象,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数;②溶液的质量;③溶液的体积;④溶液中所含水的质量.其中正确的是( )
某课外兴趣小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图的函数图象,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数;②溶液的质量;③溶液的体积;④溶液中所含水的质量.其中正确的是( )分析:解答时根据浓硫酸的性质及溶质质量分数、溶液的组成来分析并解答该题;浓硫酸具有吸水性,能吸收空气中的水分而使溶液变稀.
解答:解:浓硫酸能够吸收空气中的水蒸气而使硫酸的质量分数降低,所以随着时间的延长溶液中水的质量要增加,溶质的质量要增加,溶液的体积也随之增加,但是由于溶质的质量不变而溶剂的质量增加,所以溶质的质量分数要降低,即坐标系中的纵坐标可以表示:②溶液的质量、③溶液的体积④溶液中所含水的质量.即选项C是正确的.
故选C.
故选C.
点评:熟练掌握常见的酸的性质,知道浓硫酸具有吸水性,敞口放置于空气中由于吸收了水蒸气而使溶液中溶质的质量分数变小.

练习册系列答案
相关题目


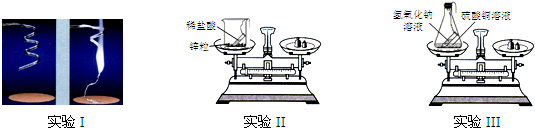
 某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )
某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )