题目内容
碱式碳酸铜可表示为:xCuCO3?yCu(OH)2?zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种.现采用氢气还原法,请回答如下问题:(1)配平xCuCO3?yCu(OH)2?zH2O与氢气反应的化学方程式
(______)xCuCO3?yCu(OH)2?zH2O+(______)H2=(______)Cu+(______)CO2↑+(______)H2O
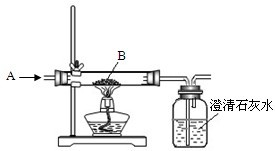
(2)实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是a→k,j→gf→de→hi→bc→l. 则最后一个干燥管中碱石灰的作用:______

(3)称取71.2g某碱式碳酸铜样品,充分反应后得到38.4g残留物,生成8.8g二氧化碳和25.2g水.该样品的结晶水质量为______ g,化学式为______.
【答案】分析:(1)根据反应前后各原子种类和个数不变配平
(2)分析实验流程中每个实验装置的作用进行解答
(3)根据化学方程式生成物之间的质量关系求出x、y、z,根据生成的水和反应物中水的关系求解水的质量.
解答:解:(1)根据反应前后原子种类和个数不变进行配平,将碱式碳酸铜前面系数定为1,反应前铜原子个数为(x+y),故在生成的铜前面加(x+y),反应前碳原子个数为x,故在生成物二氧化碳产面加x,反应前氧原子个数为3x+2y+z,生成物二氧化碳中氧原子个数为2x,根据氧原子个数相等,故在水前面加(x+2y+z),根据反应前后氢原子个数相等可得出氢气前面加(x+y)
(2)根据实验流程可以看出,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;
(3)设
xCuCO3?yCu(OH)2?zH2O+( x+y)H2=( x+y)Cu+xCO2↑+( x+2y+z)H2O
64(x+y) 44x 18(x+2y+z)
38.4g 8.8g 25.2g
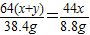
解得:y=2x
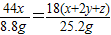
解得:z=2x
令x=1,则y=2,z=2
则化学式为CuCO3?2Cu(OH)2?2H2O
化学方程式为
CuCO3?2Cu(OH)2?2H2O+3H2=3Cu+CO2↑+7H2O
由化学方程式可以看出,碱式碳酸铜每两个水分子能生成7个水分子,即生成的水中碱式碳酸铜中水占了 ,因此碱式碳酸铜中水的质量为:25.2g×
,因此碱式碳酸铜中水的质量为:25.2g× =7.2g
=7.2g
故答案为:
(1)1 (x+y) (x+y) x (x+2y+z)
(2)防止空气中CO2和H2O进入装置,影响测定 结果
(3)7.2
CuCO3?2Cu(OH)2?2H2O (其他合理答案也给分)
点评:本题是一信息题,难度较大,关键是配平化学方程式,能根据实验流程分析出装置的作用,能根据化学方程式进行计算.
(2)分析实验流程中每个实验装置的作用进行解答
(3)根据化学方程式生成物之间的质量关系求出x、y、z,根据生成的水和反应物中水的关系求解水的质量.
解答:解:(1)根据反应前后原子种类和个数不变进行配平,将碱式碳酸铜前面系数定为1,反应前铜原子个数为(x+y),故在生成的铜前面加(x+y),反应前碳原子个数为x,故在生成物二氧化碳产面加x,反应前氧原子个数为3x+2y+z,生成物二氧化碳中氧原子个数为2x,根据氧原子个数相等,故在水前面加(x+2y+z),根据反应前后氢原子个数相等可得出氢气前面加(x+y)
(2)根据实验流程可以看出,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;
(3)设
xCuCO3?yCu(OH)2?zH2O+( x+y)H2=( x+y)Cu+xCO2↑+( x+2y+z)H2O
64(x+y) 44x 18(x+2y+z)
38.4g 8.8g 25.2g
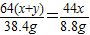
解得:y=2x
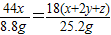
解得:z=2x
令x=1,则y=2,z=2
则化学式为CuCO3?2Cu(OH)2?2H2O
化学方程式为
CuCO3?2Cu(OH)2?2H2O+3H2=3Cu+CO2↑+7H2O
由化学方程式可以看出,碱式碳酸铜每两个水分子能生成7个水分子,即生成的水中碱式碳酸铜中水占了
 ,因此碱式碳酸铜中水的质量为:25.2g×
,因此碱式碳酸铜中水的质量为:25.2g× =7.2g
=7.2g故答案为:
(1)1 (x+y) (x+y) x (x+2y+z)
(2)防止空气中CO2和H2O进入装置,影响测定 结果
(3)7.2
CuCO3?2Cu(OH)2?2H2O (其他合理答案也给分)
点评:本题是一信息题,难度较大,关键是配平化学方程式,能根据实验流程分析出装置的作用,能根据化学方程式进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 30、甲、乙、丙、丁、戊是初中化学常见的物质.如图中的五个圆分别表示这五种物质,用两圆相切表示这两种物质能发生反应,“→”表示物质间的转化关系(部分反应物、生成物及反应条件已略去).
30、甲、乙、丙、丁、戊是初中化学常见的物质.如图中的五个圆分别表示这五种物质,用两圆相切表示这两种物质能发生反应,“→”表示物质间的转化关系(部分反应物、生成物及反应条件已略去).