题目内容
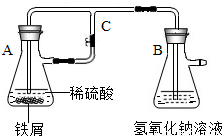 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:按照右图进行实验,容器A中的反应开始时,活塞C处于打开状态,一段时间后,关闭活塞C,容器A中的反应仍在进行.最终在______容器中观察到白色沉淀(填“A”或“B”)
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2?nH2O所致.用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势.
加热时,“方法一”中弹簧夹C应处于打开状态,容器A中的反应须处于发生状态.该实验中支持乙同学观点的化学方程式:Fe(OH)2?nH2O
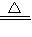 Fe(OH)2+nH2O.
Fe(OH)2+nH2O.(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路.______.
【答案】分析:根据所设计实验装置,关闭活塞C会使铁与硫酸反应放出的氢气不能排出而致使瓶A内压强增大,A瓶内压强增大使该瓶内溶液压入B瓶,并与B瓶内氢氧化钠发生反应;
(1)根据资料中关于Fe(OH)2与Fe(OH)3的颜色信息,可判断实验中出现的灰绿色或绿色现象既非Fe(OH)2也非Fe(OH)3,而应该是二者混合的结果;根据铁元素的化合价,由物质Fe3(OH)8中铁元素化合价总和应为+8,可推断该物质的分子中含+2价Fe2+一个、+3价Fe3+二个,把铁、氢元素与氧元素结合成氧化物,而改写其化学式;
(3)根据沉淀由“白”变“绿”的现象是由于Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故分析,因此可采取向Fe2+和Fe3+的混合液中加入NaOH溶液生成其混合物或直接把两种物质混合,观察颜色的方法以验证沉淀由“白”变“绿”的原因.
解答:解:关闭活塞C,A瓶内铁粉与稀硫酸反应放出的氢气不能排出而使瓶内气体增加,压强逐渐增大,把反应生成的硫酸亚铁溶液压入B瓶内,氢氧化钠与硫酸亚铁发生反应而生成氢氧化亚铁的沉淀;因此,在B瓶内观察到沉淀产生;
(1)由资料信息可知,氢氧化亚铁为白色而氢氧化铁为棕色,二者的混合物呈现出绿色,因此实验中出现灰绿色或绿色的现象应是生成的Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故;资料中提及的微绿色Fe3(OH)8,可理解为Fe(OH)2与Fe(OH)3的结合起的一种物质,其中既有+2价铁也有+3价铁,因此改写为氧化物的形式时,8个氢原子应结合成4H2O,所以应写成:FeO?Fe2O3?4H2O;
(3)由于出现的沉淀由白变绿是因为形成了Fe(OH)2与Fe(OH)3的混合沉淀,因此可利用向Fe2+和Fe3+的混合液中直接加入NaOH溶液,反应生成Fe(OH)2与Fe(OH)3的混合沉淀物,观察此时沉淀物的颜色,或直接取Fe(OH)2与Fe(OH)3进行混合,观察混合后颜色的方法,以解释沉淀由“白”变“绿”的现象.
故答案为:
B;
(1)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3;FeO?Fe2O3?4H2O;
(3)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色.[或者将Fe(OH)3和Fe(OH)2混合后观察其颜色.](合理答案均给分)
点评:根据实验的装置图及所提供资料的分析,正确理解实验的目的及出现现象的原因,对于解答此新知识的探究型问题是尤其重要的.
(1)根据资料中关于Fe(OH)2与Fe(OH)3的颜色信息,可判断实验中出现的灰绿色或绿色现象既非Fe(OH)2也非Fe(OH)3,而应该是二者混合的结果;根据铁元素的化合价,由物质Fe3(OH)8中铁元素化合价总和应为+8,可推断该物质的分子中含+2价Fe2+一个、+3价Fe3+二个,把铁、氢元素与氧元素结合成氧化物,而改写其化学式;
(3)根据沉淀由“白”变“绿”的现象是由于Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故分析,因此可采取向Fe2+和Fe3+的混合液中加入NaOH溶液生成其混合物或直接把两种物质混合,观察颜色的方法以验证沉淀由“白”变“绿”的原因.
解答:解:关闭活塞C,A瓶内铁粉与稀硫酸反应放出的氢气不能排出而使瓶内气体增加,压强逐渐增大,把反应生成的硫酸亚铁溶液压入B瓶内,氢氧化钠与硫酸亚铁发生反应而生成氢氧化亚铁的沉淀;因此,在B瓶内观察到沉淀产生;
(1)由资料信息可知,氢氧化亚铁为白色而氢氧化铁为棕色,二者的混合物呈现出绿色,因此实验中出现灰绿色或绿色的现象应是生成的Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故;资料中提及的微绿色Fe3(OH)8,可理解为Fe(OH)2与Fe(OH)3的结合起的一种物质,其中既有+2价铁也有+3价铁,因此改写为氧化物的形式时,8个氢原子应结合成4H2O,所以应写成:FeO?Fe2O3?4H2O;
(3)由于出现的沉淀由白变绿是因为形成了Fe(OH)2与Fe(OH)3的混合沉淀,因此可利用向Fe2+和Fe3+的混合液中直接加入NaOH溶液,反应生成Fe(OH)2与Fe(OH)3的混合沉淀物,观察此时沉淀物的颜色,或直接取Fe(OH)2与Fe(OH)3进行混合,观察混合后颜色的方法,以解释沉淀由“白”变“绿”的现象.
故答案为:
B;
(1)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3;FeO?Fe2O3?4H2O;
(3)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色.[或者将Fe(OH)3和Fe(OH)2混合后观察其颜色.](合理答案均给分)
点评:根据实验的装置图及所提供资料的分析,正确理解实验的目的及出现现象的原因,对于解答此新知识的探究型问题是尤其重要的.

练习册系列答案
相关题目
某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x,y,z为正整数)受热易分解,类似碱式碳酸铜,Cu2(OH)2CO3═2CuO+CO2↑+H2O]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是 ;A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 .
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是 、 ,其作用是: ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”).
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是 .
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是 _;
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是 .
(6)实验测得数据如下:
从上面表格中得出生成的水质量 g,生成的二氧化碳质量 g,请通过计算推导出该碱式碳酸镁的化学式 (写出计算过程),计算过程:
该碱式碳酸镁受热分解的化学方程式为 .
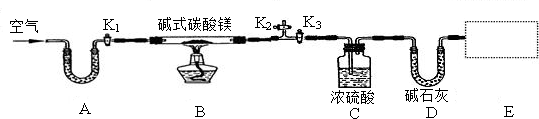
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是
(2)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加药品和仪器分别是
(3)取22,6g该样品放在研钵中研成粉末放于硬质玻璃管中,研碎的目的是
(4)加热前先打开活塞K1,K2,关闭K3,缓缓鼓入空气数分钟,其通空气目的是
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其通空气目的是
(6)实验测得数据如下:
| 反应前 | 反应后 |
| C装置及药品总质量:87,6g | C装置及药品总质量:89,4g |
| D装置及药品总质量:74,7g | D装置及药品总质量:83,5g |
该碱式碳酸镁受热分解的化学方程式为

位于清远市连州境内的“连州地下河”是闻名遐迩的旅游景点.
(1)有一位游客在洞内将装满水的矿泉水瓶中的水倒掉,然后盖紧瓶盖,很高兴地说:“我可以用这瓶气体很准确地测定洞内空气成分及含量.”你已经知道,用排水法收集到的气体常常含有较多的水蒸汽.要收集到洞内真实的空气,你对游客有什么好的建议:______.
(2)洞内不但可以欣赏如诗如画美景,还可以河上泛舟.请你设计一简单的实验方法探究洞内河水是否为硬水:______.
(3)某研究性学习小组对洞内河水进行了进一步的探究.以下是对由煮沸洞内河水产生的水垢所作的探究的一部分,请完成相关问题.
[探究课题]探究水垢的主要成分
[查阅资料]天然水中一般含有Ca2+、Mg2+、HCO3-等离子,加热时这些离子趋于生成溶解度更小的物质从而形成水垢(主要成分为碳酸盐、碱等的混合物).下面是有可能成为水垢成分的一些物质的溶解性情况:
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Mg(OH)2 | Ca(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 不溶 | 微溶 | 不溶 | 微溶 |
下面是根据设计方案进行的实验并得出的相关结论:
在试管A中放入适量研碎的水垢,加入适量的蒸馏水,充分震荡.
①取试管A中一定量的上层清液放入另一支试管B中,加入______溶液,没有白色沉淀,证明水垢中无Ca(OH)2.
②将试管A中的剩余上层清液倒出,然后试管A中加入______溶液,有气泡产生,将产生的气体通入澄清的石灰水中,石灰水变浑浊,说明水垢中一定含有碳酸盐.