题目内容
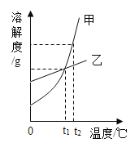
【题目】下图是甲、乙、丙三种物质的溶解度曲线,请回答下列问题
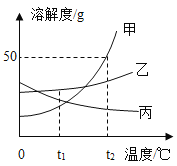
(1)t1℃时,三种物质中溶解度最大的是_____;
(2)溶解度随温度升高而减少的是_____;
(3)t2℃时,将质量相等的甲、乙、丙三种物质的饱和溶液降温至t1℃,析出晶体最多的是_____;
(4)t2℃时,将30g甲物质加入50g水中充分搅拌,形成甲物质的_____(填“饱和溶液”或“不饱和溶液”),此溶液的质量为_____g。
【答案】乙 丙 甲 饱和溶液 75
【解析】
(1)由图可知,t1℃对应的三条溶解度曲线的纵坐标中,乙最大,因此t1℃时,三种物质中溶解度最大的是乙;
(2)由图可知,溶解度随温度升高而减少的是丙;
(3)t2℃时,三种物质的溶解度大小关系为:甲>乙>丙,t1℃时,三种物质的溶解度大小关系为:乙>丙>甲,t2℃时,将质量相等的甲、乙、丙三种物质的饱和溶液降温至t1℃,溶解度变化最大的是甲,因此,析出晶体最多的是甲;
(4)由图可知,t2℃时,甲的溶解度是50g,因此该温度下100g水最多能够溶解50g甲,则该温度下50g水最多能够溶解25g甲,所以t2℃时,将30g甲物质加入50g水中充分搅拌,形成甲的饱和溶液,此时溶液的组成为:溶质质量为25g,溶剂质量为50g,则溶液质量=25g+50g=75g。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
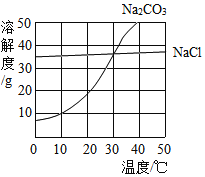
三点一测快乐周计划系列答案【题目】下表是 20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液:配制 50g11%氢氧化钠溶液的基本步骤是:计算—称取氢氧化钠固体—量取水—溶解—装瓶贴标签。 用托盘天平称取氢氧化钠固体的质量_________ g。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向稀氢氧化钠溶液中通入 CO2,先生成 Na2CO3,继续通入 CO2,Na2CO3 会转化为 NaHCO3,已知后者为化合反应,请写出该化合反应的化学方程式:_________。 若向 20℃时饱和 Na2CO3 溶液中通入过量的 CO2,可观察到的现象是_________。
②结合表格中的有关数据,若以 20℃时,100g 饱和溶液吸收 CO2 的质量最大为依据,则除去 CO 气体中的 CO2 杂质,应选择_________溶液(填化学式),欲检验CO2气体的存在,则应选择_________溶液(填化学式)。
③将 2.2g CO2 通入 47.8g 一定浓度的 NaOH溶液中充分反应后(反应过程中没有CO2 逸出,水也没有蒸发),溶液中的溶质仅有 Na2CO3和 NaHCO3 两种物质(NaHCO3 在水中电离成 Na+和 HCO3-),则此时溶液中碳元素的质量分数为__________,在此反应过程中,你认为钠离子的个数_________发生变化?(填写: 有或者没有)
(3)电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份置于两个烧杯中 并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法正确的是__________
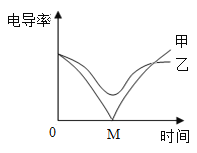
a.乙曲线电导率减小过程中,溶液由红色变为无色
b.乙曲线对应的反应中四种离子数目都减少
c.甲曲线对应氢氧化钡与硫酸钠反应
d.甲曲线上的 M 点代表两种溶液恰好完全反应
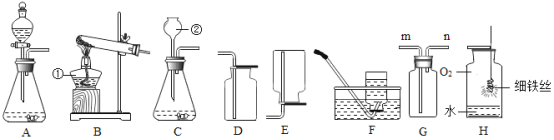
【题目】下列关于化学实验的“目的-操作-现象-结论”的描述正确的是( )
实验目的 | 操作 | 实验现象 | 实验结论 | |
A | 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 | 在反应后的溶液中滴加无色酚酞试液 | 无明显现象 | 恰好完全反应 |
B | 判断海水和蒸馏水 | 蒸发结晶 | 液体消失,无残留物 | 该液体为蒸馏水 |
C | 检验溶液中是否含硫酸根离子 | 加入氯化钡溶液,再加入稀硝酸 | 有白色沉淀产生 | 溶液中一定含硫酸根离子 |
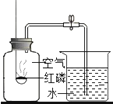
D | 测定空气中氧气的体积分数 |
| 红磷燃烧,产生大量白色烟雾;完全燃烧后,立即打开弹簧夹,进入水的体积约为集气瓶总体积的五分之一 | 氧气约占空气体积的五分之一 |
A. A B. B C. C D. D