题目内容
 (2013?徐州)已知金属钠能与水发生如下反应:2Na+2H2O═2NaOH+H2↑,若把4.6g金属钠投入到盛有足量水的烧杯中(如图),充分反应后烧杯中剩余溶液质量是40g,请计算:
(2013?徐州)已知金属钠能与水发生如下反应:2Na+2H2O═2NaOH+H2↑,若把4.6g金属钠投入到盛有足量水的烧杯中(如图),充分反应后烧杯中剩余溶液质量是40g,请计算:(1)生成NaOH的质量.
(2)反应后所得NaOH溶液的溶质质量分数.
分析:根据钠与水反应的方程式,由钠的质量求出氢氧化钠的质量,再根据溶质质量分数计算公式,求出NaOH溶液的溶质质量分数.
解答:解:(1)设生成的NaOH的质量为x
2Na+2H2O═2NaOH+H2↑
46 80
4.6g x
=
解得:x=8g
(2)反应后所得NaOH溶液的溶质质量分数为
×100%=20%
答:(1)生成NaOH的质量是8g;(2)反应后所得NaOH溶液的溶质质量分数是20%.
2Na+2H2O═2NaOH+H2↑
46 80
4.6g x
| 46 |
| 80 |
| 4.6g |
| x |
(2)反应后所得NaOH溶液的溶质质量分数为
| 8g |
| 40g |
答:(1)生成NaOH的质量是8g;(2)反应后所得NaOH溶液的溶质质量分数是20%.
点评:本题主要考查学生根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力及溶质质量分数的计算问题.根据化学方程式的计算,就是依据反应物和生成物间的质量比进行的;已知反应物的质量可以算出生成物的质量,反之,已知生成物的质量也可以算出所需反应物的质量.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
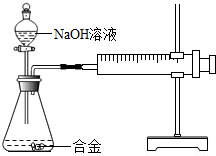 (2013?徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
(2013?徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动. (2013?徐州二模)A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题:
(2013?徐州二模)A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题: