题目内容
【题目】小松同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
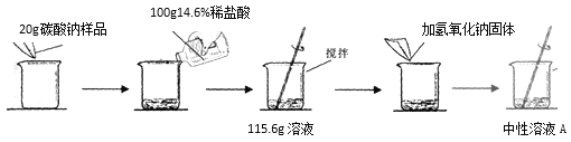
(1)用36.5%的浓盐酸配制上述质量分数为14.6%的稀盐酸,需要水的质量为______;
(2)样品中参加反应的化学方程式__________________________;
(3)根据已知条件列出求解20g样品中参加反应的物质质量(X)的比例式_____;
(4)该样品中碳酸钠的质量分数______;
(5)向中性溶液A中加入76.4g水,最终得到溶液中溶质质量分数是_________;
(6)若将20t样品中的纯碱转化为烧碱,则制得含杂质的烧碱_______t。
【答案】 60g Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106/44=X/4.4g 53% 11.7% 17.4
【解析】1)用36.5%的浓盐酸配制上述质量分数为14.6%的稀盐酸,需要水的质量为m;100g×14.6%=(100g-m) ×36.5% m=60g;(2)盐酸和碳酸钠反应生成氯化钠、二氧化碳、水,反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)由题中信息可知生成二氧化碳的质量为:100g+20g-115.6g=4.4g,设20g样品中参加反应的物质质量(X);参加反应的的氯化氢质量为y,生成氯化钠质量为g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
X y g 4.4g
106/44=X/4.4g x=10.6g
73/y=44/4.4g y=7.3g
117/g=44\4.4g g=11.7g
设将溶液反应至中性,需要加入氢氧化钠的质量为n;生成氯化钠的质量为h
NaOH + HCl = NaCl+H2O
40 36.5 58.5
n 7.3g h
40/n=36.5/7.3g n=8g
58.5/h=36.5/7.3g h=11.7g
(4)该样品中碳酸钠的质量分数10.6g÷20g×100%=3%;
(5)向中性溶液A中加入76.4g水,最终得到溶液中溶质质量分数是11.7g×2÷(20g+100g+8g-4.4g+76.4g)×100%=11.7%;
(6)若将20t样品中杂质的质量为:20g-10.6g=9.4g;纯碱与烧碱的质量比为106~80,10.6g纯碱转化为烧碱,则制得烧碱8g,得含杂质的烧碱:8g+9.4g=17.4g
答:略

 阅读快车系列答案
阅读快车系列答案