题目内容
【题目】科学小组的同学对模拟湿法炼铜实验中得到的铁、铜固体混合物进行含量测定。称取10克固体混合物置于烧杯中,滴加一定质量分数的稀硫酸溶液,记录并绘制了如图所示的曲线。
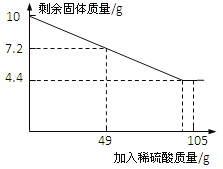
(1)10克固体混合物中铜的质量为______克。
(2)所用稀硫酸溶液溶质的质量分数是多少?(写出计算过程)
【答案】(1)4.4 (2)10%
【解析】
试题分析:(1)铁、铜固体混合物中加入稀硫酸,只有铁能与稀硫酸反应生成硫酸亚铁和氢气:
Fe+H2SO4 = FeSO4+H2↑ ,铜不能与硫酸反应。故根据曲线,剩余的固体即是铜,其质量是4.4g;
(2)根据图中数据可知,加入49克稀硫酸时消耗铁的质量为
m(Fe)=10g–7.2g = 2.8g。
Fe + H2SO4 = FeSO4+H2↑
56 98
2.8g m(H2SO4)
56∶98 =2.8g∶m(H2SO4)
m(H2SO4) = 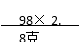 = 4.9 g
= 4.9 g
H2SO4%= 4.9g/49g ×100% =10%

练习册系列答案
相关题目