题目内容
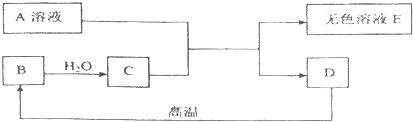
A为含三种元素的钠盐,C为相对分子质量为100的白色不溶物,请完成下列问题:
(1)写出下列物质的化学式A B C ;
(2)物质A、B混合加入水后发生反应的化学方程式有 、 ;
(3)D中一定含有的溶质是 ,可能含有的溶质是 .
【答案】分析:根据C为相对分子质量为100的白色不溶物,推测C可能为CaCO3,CaCO3高温分解生成氧化钙,则物质B为二氧化碳或氧化钙;由题意可知,物质A(钠盐)、B混合加入水后发生反应生成沉淀C碳酸钙(CaCO3),利用代入法,假设B是二氧化碳,二氧化碳与A(钠盐)在水中不会生成碳酸钙沉淀,B则物质为氧化钙,氧化钙与水生成的氢氧化钙与钠盐A反应生成碳酸钙沉淀,则钠盐A为碳酸钠.
解答:解:(1)C为相对分子质量为100的白色不溶物,推测C可能为CaCO3,CaCO3高温分解生成氧化钙,则物质B为二氧化碳或氧化钙;由题意可知,物质A(钠盐)、B混合加入水后发生反应生沉淀C碳酸钙(CaCO3),利用代入法,假设B是二氧化碳,二氧化碳与A(钠盐)在水中不会生成碳酸钙沉淀,B则物质B为氧化钙,氧化钙与水生成的氢氧化钙与钠盐A反应生成碳酸钙沉淀,则钠盐A为碳酸钠;
(2)B为氧化钙与水化合生成氢氧化钙,氢氧化钙由与碳酸钠反应,方程式:CaO+H2O═Ca(OH)2,
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)由于反应物碳酸钠或氢氧化钙可能过量,反应后溶液可能混有碳酸钠或氢氧化钙之一,所以反应后溶液的组成一定有NaOH,可能有Na2CO3或Ca(OH)2;
故答(1)Na2CO3,CaO,CaCO3;(2)CaO+H2O═Ca(OH)2,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)NaOH,Na2CO3或Ca(OH)2.
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,.直接得出结论,如本题关键是推出C为碳酸钙,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.
解答:解:(1)C为相对分子质量为100的白色不溶物,推测C可能为CaCO3,CaCO3高温分解生成氧化钙,则物质B为二氧化碳或氧化钙;由题意可知,物质A(钠盐)、B混合加入水后发生反应生沉淀C碳酸钙(CaCO3),利用代入法,假设B是二氧化碳,二氧化碳与A(钠盐)在水中不会生成碳酸钙沉淀,B则物质B为氧化钙,氧化钙与水生成的氢氧化钙与钠盐A反应生成碳酸钙沉淀,则钠盐A为碳酸钠;
(2)B为氧化钙与水化合生成氢氧化钙,氢氧化钙由与碳酸钠反应,方程式:CaO+H2O═Ca(OH)2,
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)由于反应物碳酸钠或氢氧化钙可能过量,反应后溶液可能混有碳酸钠或氢氧化钙之一,所以反应后溶液的组成一定有NaOH,可能有Na2CO3或Ca(OH)2;
故答(1)Na2CO3,CaO,CaCO3;(2)CaO+H2O═Ca(OH)2,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)NaOH,Na2CO3或Ca(OH)2.
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,.直接得出结论,如本题关键是推出C为碳酸钙,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.

练习册系列答案
相关题目