题目内容
【题目】利用图甲装置探究“MnO2 的用量对 H2O2 分解反应的影响”,实验中 H2O2 的溶质质量分 数为 3%,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内 压强成正比。反应放热忽略不计)
(1)写出装置中发生反应的文字或符号表达式:___,MnO2 在此反应前后___和__不发生改变。
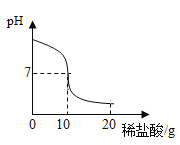
(2)图乙是“0.1 克 MnO2 不同体积的 3% H2O2 溶液混合”的实验结果,从图中可以看______。
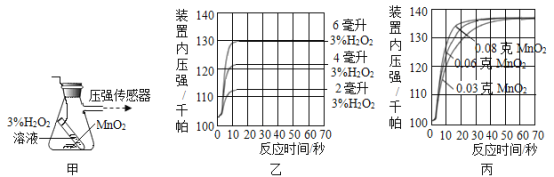
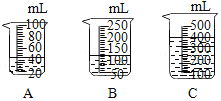
(3)当用“3% H2O2 溶液 8 毫升与不同质量的 MnO2 混合”时,得到如图丙所示的曲线。曲线的斜率显示,当 MnO2 的用量增加到 0.08 克时,分解速度达到实验要求。 在此实验条件下,若 MnO2 的质量有 4 克(一药匙),就能使如图_____(选填字母)烧杯 中所装的 3% H2O2 溶液,其分解速度最接近实验要求。
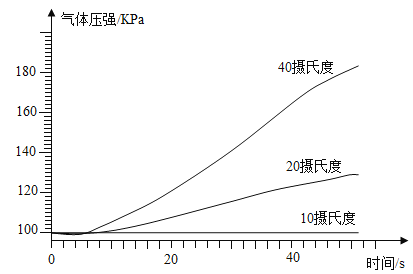
(4)使用压强传感器等设备,检测不同温度下过氧化氢分解时气体压强的变化。经过实验、数据处理等,获得如右图所示的压强-时间的曲线变化。由此可知,其它条件一定时,温度越高,过氧化氢的分解速率______(填 “越快”、“越 慢”或“不变”);
(5)请你设计实验方案,探究浓度对过氧化氢分解速率的影响(写出简要的实验步骤)______。
【答案】H2O2![]() H2O+O2质量化学性质过氧化氢体积越大,分解产生的氧气越多C越快在两支试管中分别加入 10mL5%和 10%的过氧化氢溶液,同时分别加入少量等量的二氧化锰,观察两支试管中产生气体的快慢。
H2O+O2质量化学性质过氧化氢体积越大,分解产生的氧气越多C越快在两支试管中分别加入 10mL5%和 10%的过氧化氢溶液,同时分别加入少量等量的二氧化锰,观察两支试管中产生气体的快慢。
【解析】
(1) 过氧化氢在二氧化锰的催化作用下生成水和氧气,符号表达式为:H2O2![]() H2O+O2;二氧化锰是催化剂,在此反应前后质量和化学性质不发生改变;
H2O+O2;二氧化锰是催化剂,在此反应前后质量和化学性质不发生改变;
(2)根据图示可以看出其他条件相同时,H2O2的用量越多,产生的氧气越多;
(3)由图示可知3%H2O2溶液8毫升与0.08克MnO2混合,分解速度达到实验要求,若MnO2的质量有4克需要3%H2O2溶液=![]() ×8mL=400mL
×8mL=400mL
(4)过氧化氢分解生成水和氧气,生成的氧气越多,压强越大,由不同温度下过氧化氢分解时气体压强如图所示的压强-时间的曲线变化,其它条件一定时,温度越高,气体的压强越大,说明过氧化氢的分解速率越快;
(5)过氧化氢溶液分解还受到过氧化氢浓度的影响,可根据控制变量法,控制其它条件相同,在两支试管中分别加入10mL5%和10%的过氧化氢溶液,同时分别加入少量等质量的二氧化锰,观察两支试管中产生气体的快慢(其它合理即可)。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)