题目内容
化学课上,老师提供信息“10gCuO用氢气还原一段时间后,称得残留固体质量为8.4g”,要求学生编制成化学计算题并求解.现摘取部分学生自编自解题中所设未知量的求解表达式,请你参照示例(1)在相关表达式右边框线上用文字简述x表示什么?(1)
| 16 |
| 1.6g |
| 18 |
| x |
| 18×1.6 |
| 16 |
(2)x=
| 1.6g×80 |
| 16 |
(3)x=
| 10g×2 |
| 80 |
| 2×1.6g |
| 16 |
分析:根据反应化学方程式及参与反应的物质进行分析解答本题.
解答:(1)根据化学方程式:CuO+H2
Cu+H2O 固体质量减少
18 16
x 10 g-8.4 g=1.6 g
可得
=
,x=
g,由此可知x表示反应后生成水的质量;
故答案为:表示反应后生成水的质量;
(2)根据化学方程式:CuO+H2
Cu+H2O 固体质量减少
80 16
y 10 g-8.4 g=1.6 g
=
y=
由此可知y为参加反应的CuO的质量,
所以 x=
÷10g×100%,则表示参加反应的CuO的质量分数;
故答案为:X表示原CuO中已分解的百分率;
(3)根据化学方程式:CuO+H2
Cu+H2O 固体质量减少
80 2 16
10 z 10g-8.4g=1.6g
=
z=
,因此z表示当残留固体质量为8.4 g时,参加反应的H2的质量,
同理可得10gCuO完全反应所需用氢气的质量为
,
所以x=
-
,x表示理论上将剩余CuO全部还原成Cu还需H2的质量;
故答案为:X表示理论上将剩余CuO全部还原成Cu还需H2的质量.
| ||
18 16
x 10 g-8.4 g=1.6 g
可得
| 16 |
| 1.6g |
| 18 |
| x |
| 18×1.6 |
| 16 |
故答案为:表示反应后生成水的质量;
(2)根据化学方程式:CuO+H2
| ||
80 16
y 10 g-8.4 g=1.6 g
| 80 |
| 16 |
| y |
| 1.6g |
| 80×1.6g |
| 16 |
所以 x=
| 1.6g×80 |
| 16 |
故答案为:X表示原CuO中已分解的百分率;
(3)根据化学方程式:CuO+H2
| ||
80 2 16
10 z 10g-8.4g=1.6g
| 2 |
| 16 |
| z |
| 1.6g |
| 2×1.6g |
| 16 |
同理可得10gCuO完全反应所需用氢气的质量为
| 10g×2 |
| 80 |
所以x=
| 10g×2 |
| 80 |
| 2×1.6g |
| 16 |
故答案为:X表示理论上将剩余CuO全部还原成Cu还需H2的质量.
点评:误区:①因为反应没有完全进行,10g、8.4g都不是参加反应的物质的质量.②反应中还有H2进入,所以不能把10g-8.4g=1.6g当成H2O的质量进行.③化学方程式是反应中数据计算的基础,如果不列方程式,只对计算式进行分析,难度会很大.
通常情况下的化学计算是考生设出未知数,然后进行求解.本题打破常规解题方法,给出解题过程,然学生寻求未知数的含义,对考查学生的理解能力很有帮助.
通常情况下的化学计算是考生设出未知数,然后进行求解.本题打破常规解题方法,给出解题过程,然学生寻求未知数的含义,对考查学生的理解能力很有帮助.

练习册系列答案
相关题目
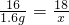 ,x=
,x=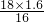 g,示例:________,
g,示例:________,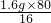 +10g×100%,________,
+10g×100%,________,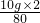 -
-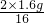 ,________.
,________. ,x=
,x= g,示例:,
g,示例:, +10g×100%,,
+10g×100%,, -
- ,.
,.