题目内容
【题目】如图是实验室所用硫酸试剂瓶上标签的部分内容,据标签内容计算:
(1)用这种硫酸配制100g 20%的稀硫酸,需要98%的浓硫酸多少毫升(精确到0.1);
(2)向49g 20%的稀硫酸中滴加10%的氯化钡溶液,直到恰好完全反应。求所得溶液的溶质质量分数(结果精确到0.1%)。

【答案】11.1ml 3.1%
【解析】
(1)使用98%的浓硫酸配制20%的稀硫酸需要进行加水稀释,加水稀释前后溶质的质量不变,可计算配制时所需要浓硫酸的质量,再根据密度公式计算出浓硫酸的体积;(2)由49g20%的稀硫酸中溶质的质量,根据反应的化学方程式计算出氯化氢的质量,进一步计算所得溶液的溶质质量分数即可。
解:(1)设需要98%的硫酸的质量为x,根据稀释前后溶质的质量不变可得: 100g×20%=x×98%,解得:x=20.4 g;需要浓硫酸的体积为:20.4 g÷1.84g/cm3=11.1mL;
(2)设参加反应的氯化钡溶液的质量为x,生成的氯化氢的质量为z,生成硫酸钡的质量为m,
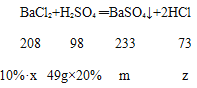
![]()
x=208g,m=23.3g,z=7.3g
所得溶液的溶质质量分数为:![]() ×100%≈3.1%。
×100%≈3.1%。
答:(1)需要98%的浓硫酸11.1mL;(2)所得溶液的溶质质量分数3.1%。

练习册系列答案
相关题目