题目内容
课外小组的同学研究的课题是测定贝壳中碳酸钙的质量分数,他们取25g贝壳粉碎后放入烧杯中,向杯中倒入稀盐酸,当倒入100g稀盐酸后发现不再产生气泡并测得烧杯内固体和液体总质量为120.6g(杂质不反应).求:
(1)生成二氧化碳的质量;
(2)贝壳中碳酸钙的质量分数.
解析:(1)根据质量守恒定律,生成CO2的质量为:100g+25g-120.6g=4.4g
(2)设参加反应的碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
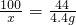
x=10g
贝壳中CaCO3的质量分数为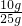 ×100%=40%
×100%=40%
答:(1)生成二氧化碳的质量是4.4g;
(2)贝壳中碳酸钙的质量分数为40%.
分析:因为碳酸钙和稀盐酸反应有二氧化碳气体放出,所以反应后烧杯中物质的总质量减少,根据质量守恒定律可知,反应后总质量的减少量就是产生的二氧化碳气体的质量.由题意可知此实验中碳酸钙完全反应,所以由二氧化碳的质量可求出碳酸钙的质量,进而求出贝壳中碳酸钙的质量分数;
点评:此题是根据化学方程式的计算,其中用到了质量守恒定律来找隐含条件,即二氧化碳的质量.此题整个计算过程比较简单,是一道基础型的计算题.
(2)设参加反应的碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
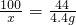
x=10g
贝壳中CaCO3的质量分数为
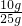 ×100%=40%
×100%=40%答:(1)生成二氧化碳的质量是4.4g;
(2)贝壳中碳酸钙的质量分数为40%.
分析:因为碳酸钙和稀盐酸反应有二氧化碳气体放出,所以反应后烧杯中物质的总质量减少,根据质量守恒定律可知,反应后总质量的减少量就是产生的二氧化碳气体的质量.由题意可知此实验中碳酸钙完全反应,所以由二氧化碳的质量可求出碳酸钙的质量,进而求出贝壳中碳酸钙的质量分数;
点评:此题是根据化学方程式的计算,其中用到了质量守恒定律来找隐含条件,即二氧化碳的质量.此题整个计算过程比较简单,是一道基础型的计算题.

练习册系列答案
相关题目
开放日,化学兴趣小组的同学自拟研究主题,对过氧化氢分解反应及催化剂做研究:
(1)小红的实验方案为:
| 催化剂 反应时间/秒 过氧化氢 | 3g氧化铜 | 3g氧化铁 | 3g二氧化锰 | 3g氧化铝 |
| 10%过氧化氢溶液10mL |
(2)小明的实验报告如图所示、
| 浓度用量 时间(min) 条件 | 30%H2O210mL | 15%H2O210mL | 5%H2O210mL |
| 加入agMnO2 | 0.2 | 0.8 | 2.0 |
(3)小刚的探究过程如下:
①[问题]MgO能不能作过氧化氢分解的催化剂呢?
②[猜想]MgO能作过氧化氢分解的催化剂.
③[实验验证]
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | A______ | 木条不复燃 | 常温下过氧化氢溶液不分解 |
| 实验二 | 在装有10mL15% 过氧化氢溶液的试管中加入少量MgO,然后将带火星的木条伸入试管中 | 木条复燃 | B______ |