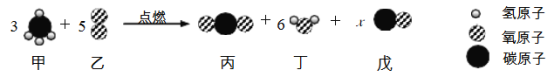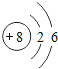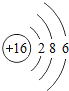题目内容
【题目】(三)铁的冶炼和探究
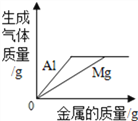
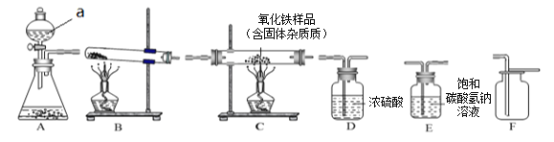
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
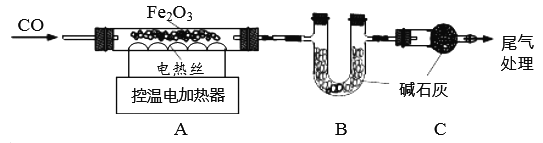
资料:碱石灰可吸收H2O和CO2。
【1】连接装置,先______________________,再装入药品。
【2】实验时先通入CO,目的是______________________________。
【3】控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
(1)通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是____。
(2)现直接测得装置A中剩余固体质量为19.2g。则装置B中固体应增重________________g。
【4】经分析A中剩余固体19.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4充分反应,得H2 0.3g。
(1)固体中Fe质量为__________________g。
(2)FexOy的化学式为__________________
【答案】
【1】 检查装置的气密性
【2】 排尽装置内的空气(氧气),防止加热时发生爆炸
【3】 防止空气中的水和二氧化碳进入装置B 13.2
【4】 8.4g FeO
【解析】
有气体参加或生成的反应,实验前需要检查装置的气密性。装置C用来吸收空气中的二氧化碳、水蒸气,防止对实验的干扰,装置B增加的质量是生成二氧化碳的质量。
【1】有气体参加或生成的反应,实验前需要检查装置的气密性,所以先连接装置,检查装置的气密性,再装入药品。
【2】任何可燃性气体与空气混合都有一个爆炸极限,在爆炸极限范围之内遇到明火会发生爆炸,一氧化碳具有可燃性,与玻璃管中的空气混合,加热时可能会发生爆炸,故先通入一氧化碳排尽玻璃管中的空气,然后加热。
【3】(1)装置C的作用是防止空气中的水和二氧化碳进入装置B,对实验造成干扰。
(2)装置A中减少的质量是参加反应的氧化铁中氧元素的质量,装置B增加的质量是生成二氧化碳的质量,设装置B中固体应增重的质量为y。
Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
160 112 3×44 160-112
y 24.0g -19.2g
![]() =
=![]() ,解得y=13.2g
,解得y=13.2g
【4】(1)剩余固体中的Fe与稀硫酸反应生成氢气,FexOy与稀硫酸反应无气体生成,设固体中Fe质量为x。
Fe+ H2SO4 == FeSO4 + H2↑
56 2
x 0.3g
![]() =
=![]() ,解得X=8.4g
,解得X=8.4g
(2)化学反应前后铁元素的质量相等,24.0g×![]() = 8.4g+(19.2g-8.4g)×
= 8.4g+(19.2g-8.4g)×![]() ,解得
,解得 ![]() =1,所以FexOy的化学式为FeO
=1,所以FexOy的化学式为FeO

【题目】工业上生产电石(CaC2)并制备重要工业原料乙炔(CxHy)流程如图1所示:
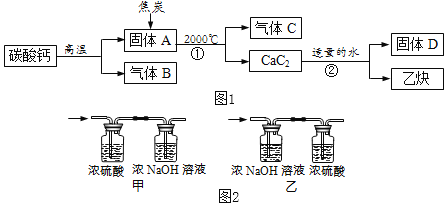
【资料】
①碳酸钙高温分解可得两种氧化物。
②浓硫酸具有强吸水性,NaOH溶液能吸收CO2。
【讨论】
(1)C、B组成元素相同,C有毒,反应①化学方程式为_____。
(2)D微溶于水,溶解度随温度升高而减小,D的化学式是_____。
【测定乙炔组成】
资料:一个乙炔分子有四个原子构成。
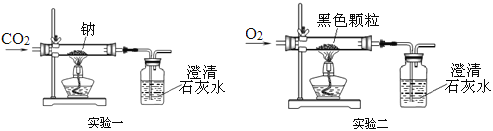
(3)将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过如图2所示的_____(选填“甲”或“乙”)装置,并再缓缓通一段时间的N2,并记录实验数据于如表中。
装置 | 反应前质量 | 反应后质量 |
浓硫酸 | 125.3g | 127.1g |
浓NaOH溶液 | 78.2g | 87.0g |
(4)实验中“缓缓通一段时间的N2”的目的是_____。
(5)计算:乙炔中碳元素质量为_____g,氢元素质量为_____g,乙炔化学式为_____。
(6)反应②的化学方程式为_____。
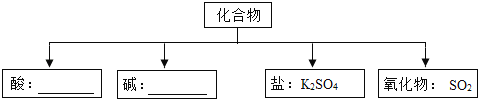
【题目】化学式在分子、原子水平上研究物质的组成、结构、性质及其应用的一门基础自然科学.
(1)现有H、O、S、K四种元素,从中选择合适的元素,根据下面物质分类的要求,组成相应类别物质的化学式,填在如图所示的横线上.
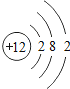
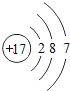
(2)下表列出了部分元素的原子结构示意图.请回答下列问题:
O | Mg | S | Cl |
|
|
|
|
氧原子的核电荷数为 ,硫原子在化学反应中易 (填“得到”或“失去”)电子,由镁元素和氯元素组成化合物的化学式为 ,氧元素和硫元素化学性质具有相似性的原因是它们的原子 相同.