题目内容
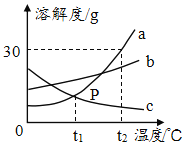
【题目】A、B、C三种固体物质的溶解度曲线如图所示,据图回答问题:
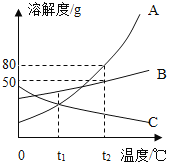
(1)温度为_____℃时,A与C物质的溶解度相等;
(2)将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,有晶体析出的是_____(填字母代号);
(3)t2℃时,把A、B物质各25g分别加到50g水中,不能形成饱和溶液的是_____(填字母代号),若要使之达到饱和状态,还需要向溶液中加入_____g该溶质。
【答案】t1 C A 15
【解析】
由A、B、C三种固体物质的溶解度曲线图可知,A物质的溶解度随温度的升高而增大,B物质的溶解度随温度的升高变化较慢,C物质的溶解度随温度的升高而减小。
(1)由溶解度曲线图可知,交点表示两种物质的溶解度相同,故温度为t1℃时,A与C物质的溶解度相等。
(2)A物质的溶解度随温度的升高而增大,B物质的溶解度随温度的升高变化较慢,C物质的溶解度随温度的升高而减小,将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,有晶体析出的是C。
(3)t2℃时,A物质的溶解度为80g,B物质的溶解度为50g,把A、B物质各25g分别加到50g水中,能溶解的A物质的质量为![]() ,25g<40g,则A为不饱和溶液,能溶解的B物质的质量为
,25g<40g,则A为不饱和溶液,能溶解的B物质的质量为![]() ,则B为饱和溶液,故不能形成饱和溶液的是A,若要使之达到饱和状态,还需要向溶液中加入的溶质的质量为
,则B为饱和溶液,故不能形成饱和溶液的是A,若要使之达到饱和状态,还需要向溶液中加入的溶质的质量为![]() 。
。

【题目】宏宏同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,宏宏邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)
该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有_____产生 | 说明该溶液已变质。变质的原因是_____(请用化学方程式表示)。 |
(2)(提出问题2)
该溶液变质程度怎样?
(提出猜想)
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有_____。
(查阅资料)
氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有_____生成 | 猜想_____成立 |
静置,取上层清液于另一支试管中,加入2﹣3滴酚酞溶液 | 上层清液变红 |
(3)(提出问题3)
怎样提纯该样品得到纯净的氢氧化钠固体。
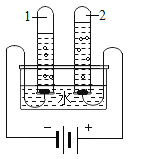
(实验探究3)
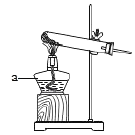
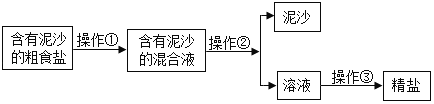
为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
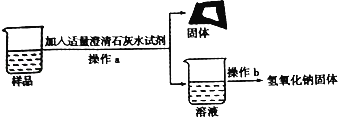
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为_____。
②根据实验流程可知,最终所得氢氧化钠固体质量_____变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)(反思交流)
在(实验探究2)中加入过量的氯化钡溶液的目的是什么?_____。
【题目】下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 |
甲 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
乙 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
丙 | 0.182 | 0.165 | 0.160 | 0.141 | x | 0.121 |
① 10℃时,甲物质的溶解度是_______g/100g水;
② 三种物质中溶解度受温度影响较大的是______;
③ 物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_________;

④ 30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
⑤ 50℃时,三种物质的溶解度由大到小的顺序是_____;
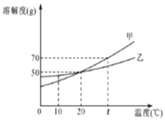
⑥ 向不同温度的100 g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是______;
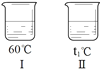

a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体全部溶解,溶质质量分数可能不变