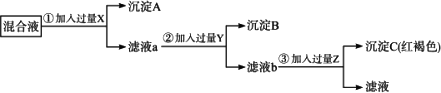
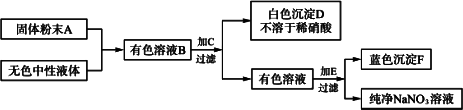
0 92032 92040 92046 92050 92056 92058 92062 92068 92070 92076 92082 92086 92088 92092 92098 92100 92106 92110 92112 92116 92118 92122 92124 92126 92127 92128 92130 92131 92132 92134 92136 92140 92142 92146 92148 92152 92158 92160 92166 92170 92172 92176 92182 92188 92190 92196 92200 92202 92208 92212 92218 92226 203614