|
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:负极反应:C6Li-xe- | |
A. |
锂离子电池充电时电池反应为C6Li+Li1-xMO2 |
B. |
电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量最小 |
C. |
锂离子电池放电时电池内部Li+向负极移动 |
D. |
锂离子电池充电时阴极反应为C6Li1-x+xLi++xe- |
|
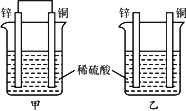
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| |
A. |
两烧杯中铜片表面均无气泡产生 |
B. |
甲中铜片是正极,乙中铜片是负极 |
C. |
两烧杯中溶液的pH均增大 |
D. |
产生气泡的速率甲比乙慢 |
|
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O | |
A. |
正极反应式为:O2+2H2O+4e- |
B. |
电池工作时,电流由铝电极沿导线流向铂电极 |
C. |
以网状的铂为正极,可增大与氧气的接触面积 |
D. |
该电池通常只需要换铝板就可以继续使用 |
|
铁-镍蓄电池充电放电时发生的反应为: Fe+NiO2+2H2O 关于此蓄电池的下列说法中不正确的是 | |
A. |
放电时Fe为负极 |
B. |
充电时阴极的电极反应式为:Ni(OH)2-2e- |
C. |
放电时NiO2的反应为:NiO2+2e-+2H2O |
D. |
蓄电池的电极必须浸在碱性电解质溶液中 |
|
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大、而且没有铅污染.其电池反应为:2Zn+O2 | |
A. |
锌为正极,空气进入负极反应 |
B. |
负极反应为Zn-2e- |
C. |
正极发生氧化反应 |
D. |
电解液肯定不是强酸 |
|
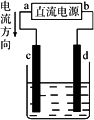
下图所示是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是
| |
A. |
a为负极、b为正极 |
B. |
a为阳极、b为阴极 |
C. |
电解过程,d电极质量增加 |
D. |
电解过程中,氯离子浓度不变 |
|
关于电解NaCl水溶液,下列叙述正确的是 | |
A. |
电解时在阳极得到氯气,在阴极得到金属钠 |
B. |
若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
C. |
若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
D. |
电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
|
把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池:若a、b相连,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由大到小为 | |
A. |
a>b>c>d |
B. |
a>c>d>b |
C. |
c>a>b>d |
D. |
b>d>c>a |