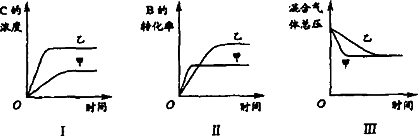|
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
下列判断一定错误的是 | |
A. |
图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
B. |
图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
C. |
图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
D. |
图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
|
将8 mol H2和2 mol N2充入2 L密闭容器中,在一定条件下进行合成氨的反应,4 min后反应达到平衡,测得容器中还有5.6 mol H2.下列计算结果错误的是 | |
A. |
v(H2)=0.3 mol·L-1·min-1 |
B. |
H2的转化率为25% |
C. |
平衡时,NH3的物质的量浓度为0.8 mol/L |
D. |
反应前后的压强比为25∶21 |
|
一定温度下,某密闭容器中发生如下反应: CO(g)+H2O(g) | |
A. |
①② |
B. |
②④ |
C. |
③④ |
D. |
①②③ |
|
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是 | |
A. |
3种溶液pH的大小顺序是③>②>① |
B. |
若将3种溶液稀释相同倍数,pH变化最大的是② |
C. |
若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是① |
D. |
若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
|
下列溶液,一定呈中性的是 | |
A. |
由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
B. |
c(H+)=1×10-7 mol/L的溶液 |
C. |
pH=14-pOH的溶液 |
D. |
pH=pOH的溶液 |
|
pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4∶1的体积比混合,则溶液中c(H+)为(mol/L) | |
A. |
1/5(4´ 10-9+1´ 10-12) |
B. |
1/5(8´ 10-9+1´ 10-12) |
C. |
5´ 10-10 |
D. |
5´ 10-12 |
|
下列事实不能用化学平衡移动原理解释的是 | |
A. |
收集氯气用排饱和食盐水的方法 |
B. |
加催化剂,使N2和H2在一定的条件下转化为NH3 |
C. |
可用浓氨水和氢氧化钠固体快速制取氨气 |
D. |
加压条件下有利于SO2和O2反应生成SO3 |
|
元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能.-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能.下表中给出了几种元素或离子的电子亲合能数据;:
下列说法正确的是 | |
A. |
电子亲合能越大,说明越难得到电子 |
B. |
一个基态的气态氟原子得到一个电子成为氟离子时放出327.9 kJ的能量 |
C. |
氧元素的第二电子亲合能是-780 kJ·mol-1 |
D. |
基态的气态氧原子得到两个电子成为O2-需要吸收能量 |
|
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定,称为洪特规则的特例.下列事实能作为这个规则证据的是 | |
A. |
元素氦(He)的第一电离能远大于元素氢(H)的第一电离能 |
B. |
26 Fe2+容易失电子转变成26Fe3+,表现出较强的还原性 |
C. |
基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2 |
D. |
某种激发态碳(C)原子排布式为1s22s12p3而不是1s22s22p2 |