|
现有三组溶液: ①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液, 分离以上各混合液的正确方法依次是 | |
| [ ] | |
A. |
分液、萃取、蒸馏 |
B. |
萃取、蒸馏、分液 |
C. |
分液、蒸馏、萃取 |
D. |
蒸馏、萃取、分液 |
|
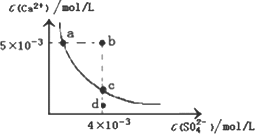
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图.下列说法正确的是
| |
| [ ] | |
A. |
CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强 |
B. |
b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
C. |
d点溶液通过蒸发可以变到c点 |
D. |
a点对应的Ksp等于c点对应的Ksp |
|
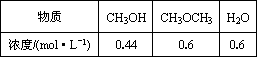
某温度下,反应2CH3OH(g)
下列说法正确的是 | |
| [ ] | |
A. |
CH3OH的起始浓度为1.04 mol/L |
B. |
此时逆反应速率大于正反应速率 |
C. |
平衡时,CH3OH的浓度为0.04 mol/L |
D. |
平衡时,CH3OH的转化率小于80% |
|
由氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为 | |
| [ ] | |
A. |
1.6a g |
B. |
(a-1.6)g |
C. |
(a-3.2)g |
D. |
无法计算 |
|
下图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和.下列说法不正确的是
| |
| [ ] | |
A. |
X元素形成的气态氢化物分子的空间结构是三角锥形 |
B. |
Z与Y元素形成的化合物熔点很高 |
C. |
W单质分子间作用力较大,加压时易液化 |
D. |
Z的最高价氧化物能溶于X的最高价氧化物的水化物中 |
|
30 ml CO2和NO混合气体通入足量的Na2O2固体并且充分反应后,气体体积变为20 ml,则原混合气体中CO2体积为(同温同压下) | |
| [ ] | |
A. |
30 mL |
B. |
20 mL |
C. |
10 mL |
D. |
无法计算 |
|
在一定条件下,向0.1 mol/L的CH3COONa溶液中滴加CH3COOH溶液至混合溶液中离子浓度满足如下关系c(Na+)+c(OH-) | |
| [ ] | |
A. |
混合溶液中:c(OH-)>c(H+) |
B. |
混合溶液中:c(CH3COO-)=0.1 mol/L |
C. |
混合溶液中:c(Na+)>c(CH3COO-) |
D. |
混合溶液中:c(Na+)=c(CH3COO-) |
|
向含0.78 mol FeCl2溶液中通入0.09 mol Cl2,再加入100 mL 1 mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为 | |
| [ ] | |
A. |
+1 |
B. |
+2 |
C. |
+3 |
D. |
+5 |
|
下列反应的离子方程式的书写中,正确的是 | |
| [ ] | |
A. |
碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH- |
B. |
向氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3- |
C. |
碳酸钙与醋酸反应:CaCO3+2H+ |
D. |
将少量二氧化硫气体通入次氯酸钠溶液中:SO2+2ClO-+H2O |
|
设NA为阿伏加德罗常数的值.下列说法正确的是 | |
| [ ] | |
A. |
标准状况下,80 g SO3所占的体积约为22.4 L |
B. |
常温常压下,1.6 g O2和O3混合气体中质子总数为0.8NA |
C. |
0.1 mol甲基(-CH3)所含电子数为NA |
D. |
在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |