|
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程上,其首要原因是 | |
| [ ] | |
A. |
利用电池外壳的金属材料 |
B. |
防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
C. |
不使电池中渗泄的电解液腐蚀其他物品 |
D. |
回收其中的石墨电极 |
|
关于电解NaCl水溶液,下列叙述正确的是 | |
| [ ] | |
A. |
电解时在阳极得到氯气,在阴极得到金属钠 |
B. |
若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
C. |
若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
D. |
电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
|
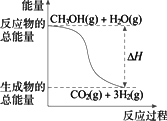
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g) ②CH3OH(g)+
下列说法正确的是 | |
| [ ] | |
A. |
CH3OH的燃烧热为192.9 kJ·mol-1 |
B. |
反应①中的能量变化如图所示 |
C. |
CH3OH转变成H2的过程一定要吸收能量 |
D. |
根据②推知反应CH3OH(l)+ |
|
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ①C(s)+O2(g) ②S(s)+O2(g) ③H2(g)+ ④CaCO3(s) | |
| [ ] | |
A. |
① |
B. |
④ |
C. |
②③④ |
D. |
①②③ |
|
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 | |
| [ ] | |
A. |
2C2H2(g)+5O2(g) |
B. |
C2H2(g)+ |
C. |
2C2H2(g)+5O2(g) |
D. |
2C2H2(g)+5O2(g) |
|
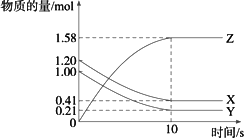
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是 | |
| [ ] | |
A. |
反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
B. |
反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1 |
C. |
反应开始到10 s,Y的转化率为79.0% |
D. |
反应的化学方程式为:X(g)+Y(g) |
|
对于可逆反应4NH3(g)+5O2(g) | |
| [ ] | |
A. |
达到化学平衡时,4v正(O2)=5v逆(NO) |
B. |
若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
C. |
达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
D. |
化学反应速率关系是:2v正(NH3)=3v正(H2O) |
|
实验室用铅蓄电池作电源电解饱和食盐水制取氯气.已知铅蓄电池放电时发生如下反应: 负极:Pb+ 正极:PbO2+4H++ 若制得0.050 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是 | |
| [ ] | |
A. |
0.025 mol |
B. |
0.050 mol |
C. |
0.10 mol |
D. |
0.20 mol |