|
下列关于元素的叙述正确的是 | |
| [ ] | |
A. |
金属元素与非金属元素能形成共价化合物 |
B. |
只有在原子中,质子数才与核外电子数相等 |
C. |
目前使用的元素周期表中,最长的周期含有36种元素 |
D. |
非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
|
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是 | |
| [ ] | |
A. |
一个D2O分子所含的中子数为8 |
B. |
NH3的结构式为 |
C. |
HCl的电子式为H+[ |
D. |
热稳定性:H2S>HF |
|
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是 | |
| [ ] | |
A. |
WX2分子中所有原子最外层都为8电子结构 |
B. |
WX2、ZX2的化学键类型和晶体类型都相同 |
C. |
WX2是以极性键结合成的非极性分子 |
D. |
原子半径大小顺序为X<W<Y<Z |
|
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是 | |
| [ ] | |
A. |
若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
B. |
若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
C. |
若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
D. |
若Y的最高正价为+m,则X的最高正价一定为+m |
|
下列说法正确的是 | |
| [ ] | |
A. |
ⅠA族元素的金属性比ⅡA族元素的金属性强 |
B. |
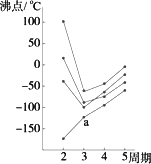
ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
C. |
同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
D. |
第3周期元素的离子半径从左到右逐渐减小 |
|
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数) | |
| [ ] | |
A. |
若R(OH)n为强碱,则W(OH)n+1也为强碱 |
B. |
若HnXOm为强酸,则Y是活泼非金属元素 |
C. |
若Y的最低化合价为-2,则Z的最高正化合价为+6 |
D. |
若X的最高正化合价为+5,则五种元素都是非金属元素 |
|
下列叙述正确的是 | |
| [ ] | |
A. |
同一主族的元素,原子半径越大,其单质的熔点一定越高 |
B. |
同一周期元素的原子,半径越小越容易失去电子 |
C. |
同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 |
D. |
稀有气体元素的原子序数越大,其单质的沸点一定越高 |
|
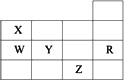
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| |
| [ ] | |
A. |
常压下五种元素的单质中Z单质的沸点最高 |
B. |
Y、Z的阴离子电子层结构都与R原子的相同 |
C. |
W的氢化物的沸点比X的氢化物的沸点高 |
D. |
Y元素的非金属性比W元素的非金属性强 |
|
铊(T1)是某超导材料的组成元素之一,与铝同族,位于第6周期.Tl3+与Ag在酸性介质中发生反应:Tl3++2AgTl++2Ag+.下列推断正确的是 | |
| [ ] | |
A. |
Tl+的最外层有1个电子 |
B. |
Tl3+的氧化性比Al3+弱 |
C. |
Tl能形成+3价和+1价的化合物 |
D. |
Tl+的还原性比Ag强 |