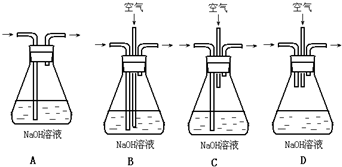
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
| 阳离子 | Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、SO42-、HSO4- |
①A溶液与B溶液反应生成白色沉淀和无色气体,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,
但不消失.
请回答:
(1)写出物质的化学式:B______,D______.
(2)写出相应的离子方程式:
Ⅰ、A溶液与C溶液反应:______.
Ⅱ、A溶液与少量E反应:______.