资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为______.
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3?yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为 ______ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量______ | ③______ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在 ______ |
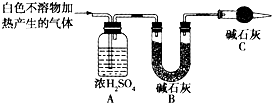
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:______.
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:______.


 已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如图(部分反应产物已略去).
已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如图(部分反应产物已略去).


