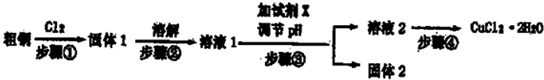
Ⅰ.硬铝废料(含90%铝、2.5%镁、7.5%铜)可以制取明矾KAl(SO4)2.12H2O,某探究小组设计了下列实验.

请回答以下问题:
(1)写出步骤③的离子方程式______.
(2)步骤④包括三个环节,分别是______、冷却结晶、______.
(3)步骤⑤不直接用水洗的原因是______.
Ⅱ.某课题小组同学测量液态奶含氮量的实验过程如下:
原理:液态奶 (NH4)2SO4溶液
(NH4)2SO4溶液 NH3
NH3 (NH4)2B4O7溶液→用标准盐酸滴定
(NH4)2B4O7溶液→用标准盐酸滴定
步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热充分反应;
②将反应液转移到大试管中;
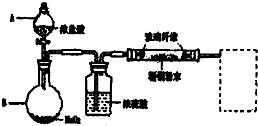
③按如下装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);

④取下锥形瓶,滴加指示剂,用0.1000mol?L-1盐酸标准液滴定;
⑤重复测定两次,再用10.00mL蒸馏水代替液态奶进行上述操作.
数据记录如下:
| 实验编号 | 样品和辅助试剂 | 消耗盐酸 体积(mL) |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55 |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 4 | 10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸 | 1.50 |
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______.
(2)步骤③的实验装置中需要加热的仪器是______(填仪器名称),长导管的作用是______.
(3)设计4号空白对照实验的目的是______.
(4)计算该液态奶的含氮量为______mg?mL-1.