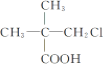【题目】一直反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)a、b、c、d、e中属于平衡状态的是_____________,100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20~40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变
B. 恒容条件下,气体的额密度不变
C. 2v正(NO2)=v逆(N2O4)/p>
D. 混合气体的平均摩尔质量不变
(5)100℃时,容器中物质的量的变化曲线如图,请画出80℃时物质的量的变化曲线并进行适当标注。______

【题目】甲、乙同学用0.10mol/L H2C2O4草酸溶液、0.01mol/L KMnO4溶液、0.01mol/L H2SO4溶液、一定量的蒸馏水等试剂,进行探究实验,通过测定溶液褪色所需时间来探究浓度、温度对反应速率的影响。
(1)已知酸性KMnO4与H2C2O4反应后Mn元素以Mn2+形式存在溶液中,C元素转化为CO2气体逸出,请写出该反应的化学方程式____________。
(2)为探究反应物浓度、温度对化学反应速率的影响。甲同学设计的实验方案如下表:
实验序号 | 温度/℃ | 体积V/ mL | |||
H2C2O4溶液 | 水 | KMnO4溶液 | H2SO4溶液 | ||
1 | 25 | 10.0 | 0.0 | 4.0 | 2.0 |
2 | 25 | 8.0 | a | 4.0 | 2.0 |
3 | 50 | b | 0.0 | 4.0 | 2.0 |
①若以实验1为对照组,为了达到实验探究目的则a=____________,b=____________。
②若实验1测得溶液褪色所需时间为5s,则用高锰酸钾表示的反应速率为______________________。
(3)乙同学部分实验设计方案如下表:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
mol/L | mL | mol/L | mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.10 | 2.0 | 0.02 | 4.0 | 25 |
…… | |||||
该同学想通过实验①和②探究反应物浓度对化学反应速率的影响,请你对该方案的合理性进行评价,并说明理由__________________________。