题目内容
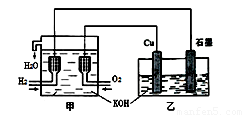
利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是
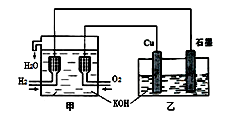
- A.乙中Cu电极的电极反应式是:
2Cu + 2OH-→ Cu2O+ H2O+ 2e- - B.甲中通入氢气的电极为正极
- C.乙中阴离子向石墨电极移动
- D.电路上通过0.5 mol电子,可制得0.5 mol Cu2O
A
甲装置为燃料电池装置,其中通入氢气的一极为负极,通入氧气的一极为正极;乙装置为电解池,铜片与正极相连为阳极,石墨为阴极;所以
A正确,乙中Cu电极的电极反应式为2Cu + 2OH-→ Cu2O+ H2O+ 2e-
B错,甲中通入氢气的电极为负极;
C错,乙中阴离子向铜电极(阳极)移动;
D错,电路上通过0.5 mol电子,可制得0.25 mol Cu2O
甲装置为燃料电池装置,其中通入氢气的一极为负极,通入氧气的一极为正极;乙装置为电解池,铜片与正极相连为阳极,石墨为阴极;所以
A正确,乙中Cu电极的电极反应式为2Cu + 2OH-→ Cu2O+ H2O+ 2e-
B错,甲中通入氢气的电极为负极;
C错,乙中阴离子向铜电极(阳极)移动;
D错,电路上通过0.5 mol电子,可制得0.25 mol Cu2O

练习册系列答案
相关题目
利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是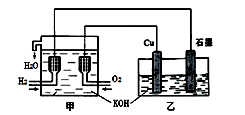
| A.乙中Cu电极的电极反应式是: 2Cu + 2OH-→ Cu2O+ H2O+ 2e- |
| B.甲中通入氢气的电极为正极 |
| C.乙中阴离子向石墨电极移动 |
| D.电路上通过0.5 mol电子,可制得0.5 mol Cu2O |