题目内容
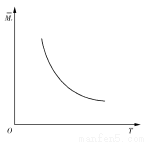
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
(1)Zn2++4OH-=Zn(OH)42— (2)10-17
(3)8.0~12.0 (4)ABCD
【解析】(1)由图可知:pH在8.0~12.0时,Zn2+主要以Zn(OH)2存在。pH>12.0时,Zn(OH)2转化为Zn(OH)42—。
(2)Ksp=c(Zn2+)·c2(OH-),当pH=7时,c(Zn2+)=10-3 mol·L-1,即Ksp=10-3·(10-7)2=10-17。
(3)由图知,应控制pH范围8.0~12.0。
(4)由表中数据可知,当Cl-浓度由小变大时,PbCl2的溶解度会先变小后变大,说明当Cl-增加到一定浓度时,PbCl2可以与Cl-形成某种离子(如配合物)而增大溶解度。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键