题目内容
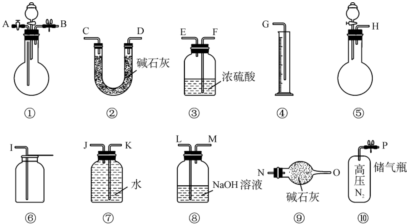
过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如图所示仪器测定样品的纯度.仪器的连接顺序:
甲同学:⑤-⑧-③-⑦-④; 乙同学:⑤-③-②.
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4═2Na2SO4+O2↑+2H2O.
(1)甲同学想通过实验测得的数据是 ,他选用的装置 (填序号)是没有必要的.
(2)乙同学想通过实验测得的数据是 .有人认为按他测得的数据计算出的实验结果可能偏高,原因是 ; 为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用): (填序号).
甲同学:⑤-⑧-③-⑦-④; 乙同学:⑤-③-②.

已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4═2Na2SO4+O2↑+2H2O.
(1)甲同学想通过实验测得的数据是
(2)乙同学想通过实验测得的数据是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)过碳酸钠和盐酸反应生成二氧化碳和氧气,甲同学通过⑤-⑧-③-⑦-④的步骤进行实验,可用⑧吸收二氧化碳,通过测量氧气的体积可确定含量;
(2)乙同学:⑤-③-②,用碱石灰吸收二氧化碳,根据二氧化碳的质量可确定含量.
(2)乙同学:⑤-③-②,用碱石灰吸收二氧化碳,根据二氧化碳的质量可确定含量.
解答:
解:(1)过碳酸钠和盐酸反应生成二氧化碳和氧气,甲同学通过⑤-⑧-③-⑦-④的步骤进行实验,可用⑧吸收二氧化碳,通过测量氧气的体积可确定含量,用排水法收集氧气,气体无需干燥,则装置③没有必要,
故答案为:生成的氧气的体积;③;
(2)乙同学:⑤-③-②,用碱石灰吸收二氧化碳,根据二氧化碳的质量可确定含量,但空气中的水与二氧化碳进入②增重使结果偏大,应在②后面连接⑨,防止空气中的水、二氧化碳进入②,且使装置内气体全部被吸收,应同氮气,以减少误差,
故答案为:生成的二氧化碳的质量;空气中的水与二氧化碳进入②增重使结果偏大;⑩①③②⑨.
故答案为:生成的氧气的体积;③;
(2)乙同学:⑤-③-②,用碱石灰吸收二氧化碳,根据二氧化碳的质量可确定含量,但空气中的水与二氧化碳进入②增重使结果偏大,应在②后面连接⑨,防止空气中的水、二氧化碳进入②,且使装置内气体全部被吸收,应同氮气,以减少误差,
故答案为:生成的二氧化碳的质量;空气中的水与二氧化碳进入②增重使结果偏大;⑩①③②⑨.
点评:本题考查较实验方案的设计,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的原理和目的,为解答该题的关键,难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、22.4L氢气中含有氢分子致目为NA |
| B、0.5mol Na2CO3中含有的Na+数目为0.5 NA |
| C、常温常压下,14g氮气含有的原子数目为NA |
| D、0.5 mol/L Fe2(SO4)3溶液中,S的数目为1.5NA |
用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1.若在标准状况下4.48L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
| A、114.8 kJ |
| B、232 kJ |
| C、368.8 kJ |
| D、173.4 kJ |
向100ml 0.4mol/L的AlCl3溶液中逐滴加入0.2mol/L的NaOH溶液,若生成1.56克氢氧化铝沉淀,则加入氢氧化钠溶液的体积为( )
| A、200 ml |
| B、400 ml |
| C、450 ml |
| D、700ml |
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )
| A、氯气:K+ Ba2+ SiO32- NO3- |
| B、二氧化硫:Na+ NH4+ SO32- C1- |
| C、氨气:K+ Na+ AlO2- CO32- |
| D、甲醛:Ca2+ Mg2+ Mn04- NO3- |

 某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).