题目内容
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释错误的是( )
| 现象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质生成且能溶于浓硝酸 |
| C | 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| D | 将铜片放入浓硫酸中,无明显实验现象 | 铜在冷的浓硫酸中发 生钝化 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.SO2使酸性高锰酸钾溶液褪色,发生氧化还原反应;
B.浓硝酸不稳定,易分解;
C.气体能使湿润的红色石蕊试纸变蓝,气体为氨气;
D.铜片放入浓硫酸中,不发生反应.
B.浓硝酸不稳定,易分解;
C.气体能使湿润的红色石蕊试纸变蓝,气体为氨气;
D.铜片放入浓硫酸中,不发生反应.
解答:
解:A.SO2使酸性高锰酸钾溶液褪色,发生氧化还原反应,生成硫酸根离子,S元素的化合价升高,则体现二氧化硫的还原性,故A正确;
B.浓硝酸不稳定,易分解,生成的二氧化氮能溶于浓硝酸则变黄,故B正确;
C.气体能使湿润的红色石蕊试纸变蓝,气体为氨气,则与碱反应时可检验该溶液中一定含有NH4+,故C正确;
D.铜片放入浓硫酸中,不发生反应,只有Fe、Al在常温下与浓硫酸或浓硝酸发生钝化,故D错误;
故选D.
B.浓硝酸不稳定,易分解,生成的二氧化氮能溶于浓硝酸则变黄,故B正确;
C.气体能使湿润的红色石蕊试纸变蓝,气体为氨气,则与碱反应时可检验该溶液中一定含有NH4+,故C正确;
D.铜片放入浓硫酸中,不发生反应,只有Fe、Al在常温下与浓硫酸或浓硝酸发生钝化,故D错误;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、离子检验等,把握物质的性质及反应现象的分析为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
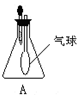 使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )
使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )| A、Cl2和饱和食盐水 |
| B、NO和水 |
| C、O2和水 |
| D、SO2和NaOH溶液 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.40mol/L.则原混合物中氧化铁的质量是( )
| A、2.4g | B、3.6g |
| C、5.6g | D、6.4g |
合成氨的温度和压强通常控制在约500℃以及200~500atm的范围,且进入合成塔的N2和H2的体积比为1:3,经科学测定,在相应条件下,N2和H2反应所得氨的平衡浓度(体积分数)如下表所示.
而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
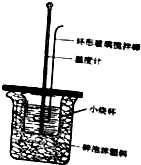 某学习小组制作如图所示简易量热计测定中和反应的反应热,烧杯中,并用温度计测量盐酸的温度;用另一个量筒量取50mL筒中的NaOH溶液一次倒入小烧杯,盖好插有温度计和环形搅拌棒的盖板,匀速搅拌,记录溶液到达的最高温度.
某学习小组制作如图所示简易量热计测定中和反应的反应热,烧杯中,并用温度计测量盐酸的温度;用另一个量筒量取50mL筒中的NaOH溶液一次倒入小烧杯,盖好插有温度计和环形搅拌棒的盖板,匀速搅拌,记录溶液到达的最高温度.