题目内容
20.氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化.实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下: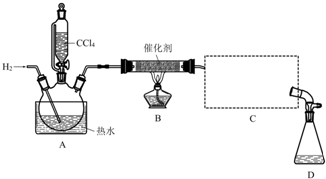
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
①检验装置气密性;②开始通入H2; ③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸、生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
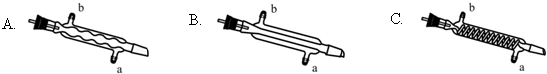
(3)C处中应选用的冷凝管为B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.
分析 (1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下;冷却水采用逆流的方式冷却效果较好;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可书写化学方程式.
解答 解:(1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿,
故答案为:加热时氢气遇氧气发生爆炸、生成的氯仿被氧气氧化;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢,反应方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl,
故答案为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下,故选B,冷却水采用逆流的方式冷却效果较好,所以冷水应从该冷凝管的a口接入,
故答案为:B;a;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤,用以洗掉NaHCO3和NaCl,
故答案为:洗掉NaHCO3和NaCl;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{15g}{24.6g}$×100%=61%,
故答案为:61%;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可知化学方程式为2CHCl3+O2=2COCl2+2HCl,
故答案为:2CHCl3+O2=2COCl2+2HCl.
点评 本题考查了物质制备方案的设计,题目难度中等,涉及仪器的使用、化学实验基本操作方法、化学计算等知识,试题知识点较多、综合性较强,充分考查了学生的化学实验、化学计算能力.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
| A. | 煤、石油中的硫元素燃烧时能生成SO2 | |
| B. | 动物尸体腐败过程产生的H2S气体会进入大气 | |
| C. | 循环过程中硫元素既发生氧化反应又发生还原反应 | |
| D. | 大气中的硫元素会全部转化成H2SO4随雨水降到土壤里 |
| A. | 吸热反应一定是反应物总能量大于生成物的总能量 | |
| B. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| C. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 配制该溶液时,将FeBr2粉末溶解在HBr溶液中,并加入少量铁钉 |
| A. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| B. | 一束可见光透过胶体时,有丁达尔效应产生 | |
| C. | 胶体属于混合物 | |
| D. | 氢氧化铁胶体能吸附水中的悬浮颗粒并沉淀,因此常用于净水 |
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A. | 锂离子电池充电时电池反应为C6Li+Li1-xMO2═LiMO2+C6Li1-x | |
| B. | 电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量大 | |
| C. | 锂离子电池放电时电池内部Li+向负极移动 | |
| D. | 锂离子电池充电时阴极反应为C6Li1-x+xLi++xe-═C6Li |
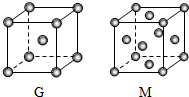 A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.