题目内容
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在.实验室从海藻中提取碘的流程如下:
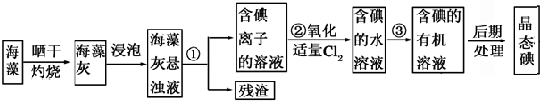
(1)指出提取碘的过程中有关实验操作的名称:
①为 ,③为 ;过程②中有关反应的离子方程式是 .
(2)提取碘的过程中可供选择的有机溶剂是
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网,以及必要的夹持装置、物品,尚缺少的玻璃仪器是 .
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图所示的实验装置中的错误之处:① ,② .

(5)进行上述蒸馏操作时,使用水浴加热的原因是 ,最后晶态碘在 里聚集.

(1)指出提取碘的过程中有关实验操作的名称:
①为
(2)提取碘的过程中可供选择的有机溶剂是
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网,以及必要的夹持装置、物品,尚缺少的玻璃仪器是
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图所示的实验装置中的错误之处:①

(5)进行上述蒸馏操作时,使用水浴加热的原因是
考点:海带成分中碘的检验
专题:实验题
分析:(1)分离固体和液体用过滤,利用溶解性的差异判断操作方法;氯气具有氧化性,能将碘离子氧化为碘单质;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(3)海藻灰中碘离子转化为碘的有机溶液,需要用到分液;
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(3)海藻灰中碘离子转化为碘的有机溶液,需要用到分液;
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
解答:
解:(1)分离固体和液体用过滤,③将碘水中的碘单质萃取出来,选择合适的萃取剂即可,过程②中有关反应的离子方程式是 Cl2+2I-=I2+2Cl-,
故答案为:过滤;萃取;Cl2+2I-=I2+2Cl-;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,碘在四氯化碳或苯中的溶解度大于在水中的溶解度,四氯化碳、甲苯、汽油或苯和水都不互溶,且氯化碳、甲苯、汽油或苯和碘都不反应,故可用四氯化碳或苯,酒精、乙酸、甘油和水都是互溶的,不能做萃取剂,
故答案为:B;
(3)海藻灰中碘离子转化为碘的有机溶液,需要用到分液,分液需要用到分液漏斗、锥形瓶,
故答案为:分液漏斗、锥形瓶;
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平,
故答案为:温度计插到了液体中;冷凝管进出水的方向颠倒;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,
故答案为:使蒸馏烧瓶均匀受热,控制加热温度不要过高;蒸馏烧瓶.
故答案为:过滤;萃取;Cl2+2I-=I2+2Cl-;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,碘在四氯化碳或苯中的溶解度大于在水中的溶解度,四氯化碳、甲苯、汽油或苯和水都不互溶,且氯化碳、甲苯、汽油或苯和碘都不反应,故可用四氯化碳或苯,酒精、乙酸、甘油和水都是互溶的,不能做萃取剂,
故答案为:B;
(3)海藻灰中碘离子转化为碘的有机溶液,需要用到分液,分液需要用到分液漏斗、锥形瓶,
故答案为:分液漏斗、锥形瓶;
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平,
故答案为:温度计插到了液体中;冷凝管进出水的方向颠倒;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,
故答案为:使蒸馏烧瓶均匀受热,控制加热温度不要过高;蒸馏烧瓶.
点评:本题考查了物质的分离和提纯,掌握过滤、萃取、蒸馏等操作是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
下列物质的沸点逐渐升高的是( )
| A、NH3 PH3 AsH3 SbH3 |
| B、CH4 SiH4 GeH4 SnH4 |
| C、CI4 CBr4 CF4 CCl4 |
| D、HF HCl HBr HI |
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2含有2nA个电子 |
| B、10L0.1mol?L-1的氨水中有nA个NH4+ |
| C、标准状况下,22.4L盐酸含有nA个HCl分子 |
| D、1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子 |
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与盐酸的反应 2OH-+2H+=2H2O |
| B、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
现有①H2SO4②酒精③液氨④纯碱固体⑤熔融的氢氧化钠⑥水银⑦三氧化硫⑧澄清石灰水⑨氯化钠溶液⑩CaCO3固体,其中属于盐的是(填序号,下同) ,属于酸性氧化物的是 ,能导电的是 ,属于电解质的是 .
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 5.0×10-13 | 8.3×10-17 |
| A、五种物质在常温下溶解度最大的是Ag2SO4 |
| B、向AgCl的悬浊液中加入0.1mol/L Na2S溶液,则可以生成黑色的Ag2S沉淀 |
| C、外界条件改变时,沉淀溶解平衡也会发生移动 |
| D、常温下,向AgI的悬浊液中加入0.1mol/L NaCl溶液,黄色沉淀变成白色沉淀 |
若在1L蒸馏水中加入1滴(约0.05mL)0.1mol?L-1的NaCl溶液,搅拌均匀后再滴入1滴0.1mol?L-1 AgNO3溶液是否会产生沉淀(已知AgCl的Ksp=1.8×10-10)( )
| A、否 | B、是 |
| C、可能是 | D、以上都不正确 |
已知常温下:
KSP[Mg(OH)2]=1.2×10-11mol3?L-3
KSP(AgCl)=1.8×10-10mol2?L-2
KSP(Ag2CrO4)=1.9×10-12mol3?L-3
KSP(CH3COOAg)=2.3×10-3mol-2?L-2
下列叙述正确的是( )
KSP[Mg(OH)2]=1.2×10-11mol3?L-3
KSP(AgCl)=1.8×10-10mol2?L-2
KSP(Ag2CrO4)=1.9×10-12mol3?L-3
KSP(CH3COOAg)=2.3×10-3mol-2?L-2
下列叙述正确的是( )
| A、等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液不一定产生CH3COOAg沉淀 |
| B、将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀 |
| C、在Mg2+为0.12mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上 |
| D、向饱和AgCl水溶液中加入NaCl溶液,KSPAgCl变大 |
 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.