题目内容
19.如图所示,可逆反应:2A(g)+B(g)?2C(g)△H<0的图象正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.△H<0为放热反应,温度高反应速率快,升高温度平衡逆向移动;
B.该反应为气体体积减小的反应,增大压强平衡正向移动;
C.该反应为放热反应,升高温度,平衡逆向移动,且正逆反应速率均增大;
D.升高温度平衡逆向移动.
解答 解:A.△H<0为放热反应,温度高反应速率快,升高温度平衡逆向移动,则温度高时先达到平衡状态,且C%的含量低,故A正确;
B.该反应为气体体积减小的反应,增大压强平衡正向移动,则交叉点后正反应速率大于逆反应速率,故B错误;
C.该反应为放热反应,升高温度,平衡逆向移动,且正逆反应速率均增大,图中速率减小不符合,故C错误;
D.升高温度平衡逆向移动,则温度高时A的转化率小,图象不符,故D错误;
故选A.
点评 本题考查化学平衡的移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图象的分析与平衡移动的结合,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
9.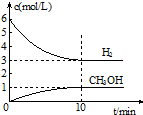 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )| A. | 0~10min内v(H2)=0.3 mol•L-1•min-1 | |
| B. | T℃时,平衡常数K=$\frac{1}{27}$,CO2与H2的转化率相等 | |
| C. | T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量 | |
| D. | 达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
10.对于平衡体系:aA(g)+bB(g)?cC(g)+dD(g)△H<0,下列判断中正确的是( )
| A. | 若a+b<c+d,增大压强,则平衡向左移动 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol | |
| D. | 若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体压强不变 |
11.(1)在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图:
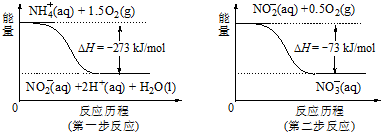
①第一步反应是放热反应(选题“放热”或“吸热”),判断依据是反应物的总能量大于生成物的总能量
②1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
(2)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
①滴定管在使用之前需要先查漏,再洗涤和润洗
②判断滴定终点的现象是无色变粉红色,且半分钟内不变色
③根据以上数据可以计算出盐酸的物质的量浓度为0.15 mol•L-1(小数点后保留两位有效数字).
④以下操作可能造成测定结果偏高的是ACE(填写序号).
A.滴定前,碱式滴定管尖嘴有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
(3)由pH=3的HA(弱酸)与pH=11的NaOH溶液等体积混合,所得溶液中离子浓度大小的顺序为c(A-)>c(Na+)>c(H+)>c(OH-).

①第一步反应是放热反应(选题“放热”或“吸热”),判断依据是反应物的总能量大于生成物的总能量
②1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
(2)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
②判断滴定终点的现象是无色变粉红色,且半分钟内不变色
③根据以上数据可以计算出盐酸的物质的量浓度为0.15 mol•L-1(小数点后保留两位有效数字).
④以下操作可能造成测定结果偏高的是ACE(填写序号).
A.滴定前,碱式滴定管尖嘴有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
(3)由pH=3的HA(弱酸)与pH=11的NaOH溶液等体积混合,所得溶液中离子浓度大小的顺序为c(A-)>c(Na+)>c(H+)>c(OH-).
9.对于一定不能自发进行的反应来说,反应后体系的( )
| A. | 混乱度增大,而能量降低 | B. | 混乱度降低,而能量增大 | ||
| C. | 混乱度降低,而能量降低 | D. | 混乱度增大,而能量增大 |