题目内容
明矾石的主要成分是K2SO4?Al2(SO4)3?2Al2O3?6H2O,此外还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:
明矾石脱水废渣调节pH溶液硫磺焙烧溶解氢氧化钠氢氧化铝母液 硫酸炉气熟料
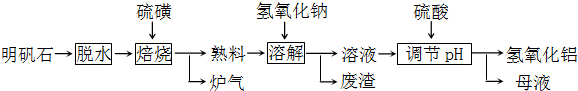
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S
2Al2O3+9SO2,其中氧化剂为 .
(2)“溶解”时反应的离子方程式为 .
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是 .
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882g/L 的H2SO4,配制1L该溶液,需用量筒量取质量分数为98%的硫酸(密度是1.8g/cm3) mL
(5)“废渣”、“母液”中可回收的物质分别是 .
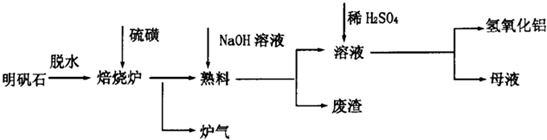
明矾石脱水废渣调节pH溶液硫磺焙烧溶解氢氧化钠氢氧化铝母液 硫酸炉气熟料

回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S
| ||
(2)“溶解”时反应的离子方程式为
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882g/L 的H2SO4,配制1L该溶液,需用量筒量取质量分数为98%的硫酸(密度是1.8g/cm3)
(5)“废渣”、“母液”中可回收的物质分别是
分析:(1)所含元素化合价降低的反应物是氧化剂;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)根据溶液稀释前后溶质的质量不变计算;
(5)废液中含有硫酸盐.
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)根据溶液稀释前后溶质的质量不变计算;
(5)废液中含有硫酸盐.
解答:解:(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,故答案为:Al2(SO4)3;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)m(H2SO4)=882g/L×1L=882g,设需要xmL浓硫酸,则有xmL×1.8g/mL×98%=882g,
x=500,
故答案为:500.0;
(5)废渣中含有Fe2O3,废液中含有K2SO4、Na2SO4,都可回收利用,故答案为:Fe2O3、K2SO4、Na2SO4.
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)m(H2SO4)=882g/L×1L=882g,设需要xmL浓硫酸,则有xmL×1.8g/mL×98%=882g,
x=500,
故答案为:500.0;
(5)废渣中含有Fe2O3,废液中含有K2SO4、Na2SO4,都可回收利用,故答案为:Fe2O3、K2SO4、Na2SO4.
点评:本题考查物质的制备、分离等知识,侧重于学生的分析能力和计算能力的考查,为高考常见题型,难度中等,注意把握物质的相关性质.

练习册系列答案
相关题目

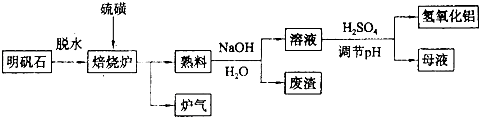

 2Al 2O3 +9SO2 ,其中氧化剂为 。
2Al 2O3 +9SO2 ,其中氧化剂为 。