题目内容
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s 后测得C的浓度为 0.6mol?L-1,现有下列几种说法:①用物质A表示的反应的平均速率为 0.6mol?(L?s)-1;②用物质B表示的反应的平均速率为 0.15mol?(L?s)-1;③2s 时物质A的浓度为1.4mol?L-1;④2s 时物质B的转化率为70%.其中正确的是( )
| A、①③ | B、①④ | C、②③ | D、③④ |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:①根据v=
计算v(C),再根据速率之比等于化学计量数之比计算v(A);
②根据v=
计算v(C),再根据速率之比等于化学计量数之比计算v(B);
③根据浓度变化量之比等于化学计量数之比计算△c(A),2s时物质A的浓度=A的起始浓度-△c(A).
④根据浓度变化量之比等于化学计量数之比计算△n(B),进而计算△n(B),根据转化率定义计算.
| △c |
| △t |
②根据v=
| △c |
| △t |
③根据浓度变化量之比等于化学计量数之比计算△c(A),2s时物质A的浓度=A的起始浓度-△c(A).
④根据浓度变化量之比等于化学计量数之比计算△n(B),进而计算△n(B),根据转化率定义计算.
解答:
解:①v(C)=
=0.3mol?L-1?s-1,速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol?L-1?s-1,故①错误;
②v(C)=
=0.3mol?L-1?s-1,速率之比等于化学计量数之比,故v(B)=
v(C)=
×0.3mol?L-1?s-1=0.15mol?L-1?s-1,故②正确;
③△c(A)=△n(C)=0.6mol?L-1,△n(A)=0.6mol?L-1×2L=1.2mol,平衡A的浓度c(A)=
=1.4mol/L,故③正确;
④根据方程式可知,△c(A)=△n(C)=0.6mol?L-1,故△n(A)=0.6mol?L-1×2L=1.2mol,△(B)=
△n(A)=0.6mol,故B的转化率=
×100%=30%,故④错误;
故选C.
| 0.6mol/L |
| 2s |
②v(C)=
| 0.6mol/L |
| 2s |
| 1 |
| 2 |
| 1 |
| 2 |
③△c(A)=△n(C)=0.6mol?L-1,△n(A)=0.6mol?L-1×2L=1.2mol,平衡A的浓度c(A)=
| 4mol-1.2mol |
| 2L |
④根据方程式可知,△c(A)=△n(C)=0.6mol?L-1,故△n(A)=0.6mol?L-1×2L=1.2mol,△(B)=
| 1 |
| 2 |
| 0.6mol |
| 2mol |
故选C.
点评:本题考查化学反应速率及化学平衡的有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
现有A、B、C三种化合物,各取40g相混合,完全反应后,测得混合物中除18.0g B、49.0g C外还生成了0.5mol的D.现将22.0g A和11.0g B反应,能生成D的量为( )
| A、26.5g |
| B、53.0g |
| C、0.5mol |
| D、1.0mol |
下列离子方程式正确的是( )
| A、漂白粉溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
| B、将0.5molCl2通入含1molFeBr2的溶液中:Cl2+2Fe2+=2Fe3++2Cl- |
| C、碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
工业上热水瓶胆镀银常用的还原剂是( )
| A、乙醛 | B、葡萄糖 |
| C、麦芽糖 | D、银氨溶液 |
下列离子方程式正确的是( )
| A、稀硫酸滴在银片上:Ag+2H+=Ag++H2↑ |
| B、硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、硝酸银溶液与盐酸反应:Ag++Cl-=AgCl↓ |
| D、澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+H2O |
下列类型的反应中,生成物中肯定有单质的是( )
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
下列热化学方程式书写正确的是( )
A、2SO2+
| ||||
| B、4H2(g)+2O2-4H2O(1)△H=-1143.2kJ?mol-! | ||||
| C、C(s)+O2(g)=CO2(g)△H=393.5kJ | ||||
| D、C(s)+O2(g)=CO2(g)△H=393.5kJ?mol-! |
铁和铁合金是生活中常用的材料,下列说法正确的是( )
| A、不锈钢是铁合金,只含金属元素 |
| B、一定条件下,铁粉可与水蒸气反应 |
| C、铁与盐酸反应,铁合金不与盐酸反应 |
| D、铁合金的硬度和强度均低于铁 |
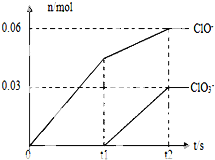 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、苛性钾溶液中KOH的物质的量是0.09mol |
| B、ClO3-的生成是由于氯气的量的多少引起的 |
| C、在酸性条件下,ClO-和ClO3-可生成Cl2 |
| D、反应中转移电子的物质的量是0.21mol |