题目内容
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A、达到平衡时X浓度为0.04 mol/L |
| B、将容器体积变为20 L,Z的平衡浓度变为0.015mol/L |
| C、若增大压强,平衡向正方向移动,平衡常数变大 |
| D、若升高温度,X的体积分数增大,则该反应的△H>0 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A、根据生成的Z的量求出转化的X的量,再求出平衡时X的浓度;
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、平衡常数只随温度的变化而变化;
D、升高温度化学平衡向吸热的方向移动.
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、平衡常数只随温度的变化而变化;
D、升高温度化学平衡向吸热的方向移动.
解答:
解:A、经60s达到平衡,生成0.3mol Z,则消耗的X为0.6mol,所以达到平衡时X浓度为
=0.04 mol/L,故A正确;
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的
,但是压强减小时,平衡向左移动,Z浓度小于原来的
,即Z的平衡浓度小于0.015mol/L,故B错误;
C、平衡常数只随温度的变化而变化,所以若增大压强,则平衡常数不变,故C错误;
D、若升高温度,X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故D错误.
故选:A.
| (1-0.6)mol |
| 10L |
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的
| 1 |
| 2 |
| 1 |
| 2 |
C、平衡常数只随温度的变化而变化,所以若增大压强,则平衡常数不变,故C错误;
D、若升高温度,X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故D错误.
故选:A.
点评:本题主要考查化学平衡移动的影响因素,根据反应物浓度、压强、温度等因素对平衡移动的影响,可以做出准确的判断,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列事实涉及的原理正确的是( )
| A、在氯碱工业中,使用阳离子交换膜的目的是隔开两极产物、导电以及维持电荷平衡 |
| B、砷是一种水体污染元素,因为其最高价含氧酸砷酸是一种强酸 |
| C、二氧化硫催化氧化过程中加热和使用催化剂,是为了同时加快速率和增大转化率 |
| D、可以往浓缩海水中通入适量二氧化碳生成碳酸镁沉淀提取镁 |
 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )| A、在t℃时,AgBr的Ksp为4.9×10-13 |
| B、图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液 |
| C、图中a点对应的是AgBr的不饱和溶液 |
| D、AgCl沉淀能较容易转化为AgBr沉淀 |
下列关系正确的是( )
| A、沸点:苯酚>甲醛>2一甲基丁烷 |
| B、2,2,3,3-四甲基丁烷、新戊烷、乙烷中化学环境相同的H原子种类由多到少 |
| C、密度:溴苯>H2O>苯 |
| D、等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH |
下列与实验操作或离子检验有关的说法正确的是( )
| A、称量一定质量NaCl固体时,没有用烧杯,直接放在右盘的滤纸上 |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42ˉ |
| C、蒸发时,待水分完全蒸干后才能停止加热 |
| D、加入硝酸酸化的硝酸钡溶液既无沉淀又无气体产生,再加入硝酸银溶液,立刻产生白色沉淀,一定有Clˉ |
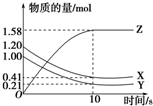 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、达平衡时Y的物质的量分数为:9.5% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
不用其它试剂鉴别:①Ba(OH)2②KCl ③Al(NO3)3④Fe2(SO4)3等四种溶液,先直接鉴别出一种,再逐一鉴别其余物质,则正确操作顺序是( )
| A、④②①③ | B、①④③② |
| C、①③④② | D、④①③② |
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(OH-)>c(HF) |
| D、c(HF)>c(F-) |
