题目内容
19.测量司机是否酒后驾驶的反应原理为:3C2H5OH+2CrO3+3H2SO4═3CH3CHO+Cr2(SO4)3+6H2O请回答下列问题:
(1)该反应涉及元素中,基态原子核外未成对电子数最多的元素在元素周期表中的位置为第四周期第VIB族
(2)该反应涉及的非金属元素中,其电负性从小到大的顺序为H<C<S<O.
(3)CH3CHO中碳原子的轨道杂化类型有2种;CrO3的空间构型为平面三角形.
(4)该反应每生成1mol CH3CHO,C2H5OH发生反应断裂σ键的数目为2NA.
(5)C2H5OH与CH3CHO的相对分子质量相差不大,但C2H5OH的沸点(78.5℃)却比CH3CHO的沸点(20.8℃)高出许多,其原因为二者都是分子晶体,C2H5OH分子间可以形成氢键,而CH3CHO分子则不能.
(6)Mo是与Cr同族的第五周期元素,则Mo原子的价电子排布式为4d55s1.
(7)三氧化铬溶于水中可得到铬酸,其溶液用于镀铬,重铬酸根(Cr2O72-)与铬酸根(CrO42-)离子在水溶液中存在下列反应:2CrO42-+2H3O+═Cr2O72-+3H2O
重铬酸根的结构式如图,则铬酸的结构式为
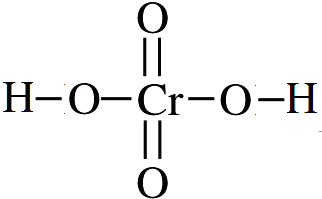 .
.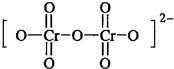
(8)将CrCl3•6H2O溶解在适量水中,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在.
①[Cr(H2O)5Cl]2+中含有σ键的数目为16;
②该溶液中不存在的化学键为C(填字母).
A.氢键 B.共价键 C.金属键 D.配位键 E.范德华力.
分析 (1)根据原子的价电子排布分析;
(2)元素的非金属性越强,其电负性越强;
(3)根据C原子的价层电子对数判断;根据CrO3中Cr原子的价层电子对数为判断;
(4)C2H5OH转化为时CH3CHO,C2H5OH中的一个C-H键和一个O-H断裂;
(5)分子间形成氢键的沸点较高;
(6)同族元素的价电子数相同;
(7)根据铬酸根离子的化学式和结构式来判断铬酸的结构式;
(8))①[Cr(H2O)5Cl]2+中Cr3+的配位数是6,H2O中含有2个共价键;
②溶液中非金属元素之间存在共价键、含有孤电子对和含有空轨道的原子之间存在配位键、分子之间存在范德华力.
解答 解:(1)Cr元素原子的价电子排布为3d54s1,含有6个未成对电子,未成对电子数最多,在周期表中位于第四周期第VIB族;
故答案为:第四周期第VIB族;
(2)元素的非金属性越强,其电负性越强,非金属性:H<C<S<O,则电负性:H<C<S<O;
故答案为:H<C<S<O;
(3)CH3CHO中全部以单键连接C原子的价层电子对数为4,属于sp3杂化,存在C=O中的C原子的价层电子对数为3,属于sp2杂化,所以C原子有2中杂化类型;CrO3中Cr原子的价层电子对数为3,属于sp2杂化,其空间构型为平面三角形;
故答案为:2;平面三角形;
(4)C2H5OH转化为时CH3CHO,C2H5OH中的一个C-H键和一个O-H断裂,则生成1mol CH3CHO,C2H5OH发生反应断裂σ键为2mol,其数目为2NA;
故答案为:2NA;
(5)氢键的作用力大于范德华力,则分子间形成氢键的沸点较高,C2H5OH分子间存在氢键,而CH3CHO分子间不能形成氢键,所以乙醇的沸点比乙醛的高;
故答案为:二者都是分子晶体,C2H5OH分子间可以形成氢键,而CH3CHO分子则不能;
(6)同族元素的价电子数相同,已知Cr元素原子的价电子排布为3d54s1,则Mo元素原子的价电子排布为4d55s1;
故答案为:4d55s1;
(7)已知铬酸根(CrO42-)的结构式为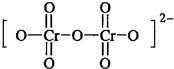 ,铬酸电离出2个氢离子即得到铬酸根离子,则铬酸的化学式为H2CrO4,其结构式为
,铬酸电离出2个氢离子即得到铬酸根离子,则铬酸的化学式为H2CrO4,其结构式为 ;
;
故答案为: ;
;
(8)①[Cr(H2O)5Cl]2+中Cr3+的配位数是6,H2O中含有2个共价键,所以该微粒中共含有6个配位键和10个共价键,则含有σ键的数目为16;
故答案为:16;
②A.水分子间存在氢键,故A不选;
B.水分子或[Cr(H2O)5Cl]2+中,非金属元素之间都存在共价键,故B不选;
C.金属单质中存在金属键,该溶液中不存在金属键,故C选;
D.[Cr(H2O)5Cl]2+中Cr原子和水分子中的O原子之间存在配位键,故D不选;
E.溶液中水分子之间存在范德华力,故E不选;
故答案为:C..
点评 本题考查比较综合,涉及元素在周期表中位置的判断、电负性的比较、杂化类型的判断、共价键、氢键、电子排布、结构式等,侧重于考查学生对基础知识的综合应用能力,题目难度中等,注意相关知识的积累.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
(2)原粉末样品中m(Fe):m(Cu)=7:8.
| A. | 胶体中分散质粒子直径大小在1~100 nm之间 | |
| B. | 可以利用丁达尔效应区分胶体和溶液 | |
| C. | 可利用过滤的方法分离胶体和溶液 | |
| D. | 胶体在一定条件下可以稳定存在 |
| A. | 5s | B. | 2p | C. | 3d | D. | 4s |
| A. | Mg2+、Al3+、F-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ne | D. | Mg2+、Na+、Cl-、S2- |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式MnO2+e-+H2O=MnOOH+OH-.
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zn0.12g.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和双氧水溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为2.7到6之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.
| A. | N2的电子式: | |
| B. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: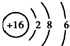 | |
| D. | O原子的基态电子排布式为:1s22s22p${\;}_{x}^{2}$p${\;}_{y}^{2}$p${\;}_{z}^{0}$. |
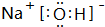 ,其中存在的化学键类型为离子键、共价键.
,其中存在的化学键类型为离子键、共价键.