题目内容
下列化学用语或模型表示正确的是( )
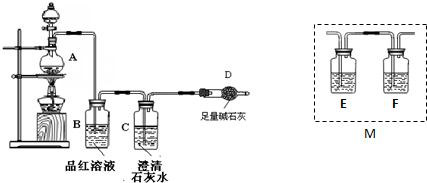
A、Cl-离子的结构示意图: |
| B、HClO的结构式:H-O-Cl |
| C、丙烯的结构简式CH3CH2CH2 |
D、CCl4分子的球棍模型: |
考点:结构式,原子结构示意图,结构简式,球棍模型与比例模型
专题:
分析:A、原子得失电子变离子,变化的是核外的电子,核内质子数不变;
B、次氯酸中氧原子与氯原子、氢原子之间分别形成1对共用电子对;
C、双键为官能团,在结构简式中不能省略;
D、球棍模型主要体现的是分子的空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系与原子间连接.
B、次氯酸中氧原子与氯原子、氢原子之间分别形成1对共用电子对;
C、双键为官能团,在结构简式中不能省略;
D、球棍模型主要体现的是分子的空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系与原子间连接.
解答:
解:A、由Cl原子得1个电子变为Cl-离子,变化的是核外的电子,核内质子数不变,Cl-离子的结构示意图为 ,故A错误;
,故A错误;
B、次氯酸中氧原子与氯原子、氢原子之间分别形成1对共用电子对,结构式为H-O-Cl,故B正确;
C、丙烯中含有C=C双键,双键不能省略,即丙烯的结构简式为:CH3CH2=CH2,故C错误;
D、图为CCl4分子的比例模型,故D错误;
故选B.
 ,故A错误;
,故A错误;B、次氯酸中氧原子与氯原子、氢原子之间分别形成1对共用电子对,结构式为H-O-Cl,故B正确;
C、丙烯中含有C=C双键,双键不能省略,即丙烯的结构简式为:CH3CH2=CH2,故C错误;
D、图为CCl4分子的比例模型,故D错误;
故选B.
点评:本题考查电子式、原子结构示意图、比例模型、结构式等,难度不大,要明确用电子式表示离子化合物、共价化合物、阴离子及单质分子的方法.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
0.5L 1.0mol?L-1FeCl3溶液与0.2L 1.0mol?L-1MgCl2溶液中的Cl-的物质的量浓度之比为( )
| A、1:1 | B、3:2 |
| C、15:4 | D、5:2 |
下列物质在生产、生活和科技等方面的叙述不正确的是( )
| A、生铁、普通钢和不锈钢中的碳含量依次增加 |
| B、硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C、节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩 |
| D、明矾在自然水中生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
下列各组离子能在溶液中大量共存的是( )
| A、Ag+、K+、NO3-、Cl- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、Ca2+、Mg2+、OH-、Cl- |
| D、H+、Na+、CO32-、OH- |
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O | ||||
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | ||||
D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2
|
下列离子方程式书写正确的是( )
| A、向氧化镁中加入硫酸溶液 Mg2++SO42-═MgSO4 |
| B、向水中加入钠块 2Na+2H2O═2Na++2OH-+H2↑ |
| C、向氢氧化钡溶液中加入过量硫酸氢钠溶液 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |