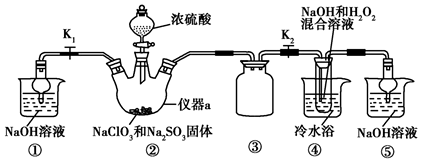
题目内容
5.实验室可以用来直接加热的玻璃仪器是( )| A. | 小试管 | B. | 容量瓶 | C. | 量筒 | D. | 蒸发皿 |
分析 能够直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;不能加热的仪器有:漏斗、量筒、集气瓶等,且蒸发皿不是玻璃仪器,以此来解答.
解答 解:A.小试管可直接加热,故A选;
B.容量瓶不能加热,为配制溶液的必要仪器,故B不选;
C.量筒为量取液体的定量仪器,不能加热,故C不选;
D.蒸发皿可直接加热,但一般为瓷制品,不是玻璃仪器,故D不选;
故选A.
点评 本题考查仪器的使用,为高频考点,把握常见仪器的使用、用途为解答的关键,侧重分析与实验能力的考查,注意常见的蒸发皿不是玻璃仪器,题目难度不大.

练习册系列答案
相关题目
12.下列反应中既属于分解反应又属于氧化还原反应的是( )
| A. | Fe+2HCl═FeCl2+H2 | B. | CH4$\frac{\underline{\;高温\;}}{\;}$C+2H2 | ||
| C. | Mg(OH)2+2HCl═MgCl2+2H2O | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |
13.下列实验能达到目的是( )
| A. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 用BaCl2溶液鉴别SO42-和SO32- | |
| D. | 用浓HNO3与Cu反应制备NO2 |
17.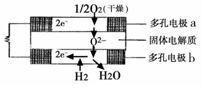 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 该电池的总反应方程式为:2H2+O2=2H2O | |
| B. | 电子由a极流向b极 | |
| C. | a极对应的电极反应式为2H2O+O2-4e=4OH- | |
| D. | 有O2参加反应的a极为电池的阳极 |
14. 国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:
国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:
Zn+2CuSO4+2NaOH=Cu2O+ZnSO4+Na2SO4+H2O.该反应的下列说法正确的是( )
 国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:
国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn+2CuSO4+2NaOH=Cu2O+ZnSO4+Na2SO4+H2O.该反应的下列说法正确的是( )
| A. | Zn得到电子 | B. | CuSO4被氧化 | C. | NaOH是还原剂 | D. | CuSO4是氧化剂 |
 的名称是2,4-二甲基戊烷,对二甲苯的结构简式是
的名称是2,4-二甲基戊烷,对二甲苯的结构简式是
 铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题:
铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题: