题目内容
(16分)(1)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
①蓄电池的负极电极反应式为__ ____。②蓄电池工作时,其中正极附近溶液的pH______(增大、减小、不变)。③实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
(2)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
①该电池充电时阳极反应式:
②放电时负极附近溶液的碱性 (填“增强”或“减弱”或“不变”)
(3) Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
①该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
②若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
③MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。
(1)① Pb - 2e- +SO42-=PbSO4 (2分) ②增大(1分) ③ 0.1mol(2分)
(2)①充电时阳极反应:Ni(OH)2 -e— + OH— == NiOOH + H2O (2分)②减弱(1分)
(3)①Zn(或锌)(1分) 正极(1分)
②Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 (2分)
③ 2H++2e-=H2↑(2分) 87g(2分)

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案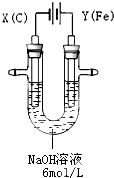 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.