题目内容
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
| A.将溶液稀释到原来体积的10倍 | B.加入适量的醋酸钠固体 |
| C.提高溶液的温度 | D.加入等体积0.2 mol·L-1盐酸 |
B
解析试题分析:A、醋酸是弱电解质,加水稀释能促进水的电离,将溶液稀释到原体积的10倍,氢离子浓度大于原来的1/10,所以pH<(a+1),故A错误;B、加入适量的醋酸钠固体,醋酸钠中含有醋酸根离子能抑制醋酸的电离,使溶液中氢离子浓度减小,所以能使溶液pH=(a+1),故B正确;C、提高温度促进醋酸的电离,使溶液中氢离子浓度增大,溶液的pH值减小,故C错误; D、加入等体积的0.2 mol?L-1盐酸,氢离子浓度增大,溶液的pH值减小,故D错误;
考点:弱电解质的电离

练习册系列答案
相关题目
在H2O+CH3COO- CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
下列事实中不能证明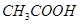 是弱电解质的是
是弱电解质的是
A.常温下某 |
B.常温下0.1mol 溶液的pH=2.8 溶液的pH=2.8 |
C. 溶液与稀盐酸反应生成 溶液与稀盐酸反应生成 |
D.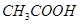 属于共价化合物 属于共价化合物 |
25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则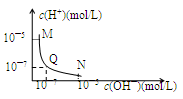
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO―)>c(Na+) |
| C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
| D.M点和N点所示溶液中H2O的电离程度相同 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D.浓度均为0.1 mol·L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③>②>① |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是
| A.Na2CO3 NaHCO3 NaCl NH4Cl | B.Na2CO3 NaHCO3 NH4Cl NaCl |
| C.(NH4)2SO4 NH4Cl NaNO3 Na2S | D.NH4Cl (NH4)2SO4 Na2S NaNO3 |
关于pH相同的醋酸和盐酸,下列叙述正确的是
| A.取等体积的醋酸和盐酸,分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n |
| B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸 |
| C.取等体积的两种酸,分别用完全一样的NaOH溶液进行中和,醋酸消耗NaOH的物质的量比盐酸消耗的多 |
| D.两种酸中c (CH3COO-) > c (Cl-) |
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A.x=y | B.x >y | C.x=10-2y | D.x=102y |