题目内容
14.下列关于化学反应速率的说法中正确的个数为( )①用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率;
②使用正催化剂,使反应的活化能降低,反应速率加快;
③一定量的锌与过量的稀硫酸反应制取氢气,为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液.
④反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则1min末的化学反应速率为v(NO)=0.06mol•L-1•min-1;
⑤增大压强,一定能加快化学反应速率;
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率;
⑦决定化学反应速率的主要因素是反应物的浓度;
⑧光是影响某些化学反应速率的外界条件之一.
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 影响化学反应速率的主要因素为物质的本身性质,外因有浓度、温度、压强、催化剂等,一般来说增大浓度、压强、升高温度、加入催化剂以及光照等可增大反应速率,以此解答该题.
解答 解:①98%的浓硫酸具有强氧化性,与铁反应生成氢气,故错误;
②正催化剂可使反应的活化能降低,加快反应速率,故正确;
③硝酸根离子在酸性条件下具有强氧化性,与锌反应不生成氢气,故错误.
④反应速率为平均速率,不是瞬时速率,故错误;
⑤增大压强,如没有气体参加反应,则不能加快化学反应速率,故错误;
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液,锌置换出铜,形成原电池反应,能加快反应速率,故正确;
⑦决定化学反应速率的主要因素是物质的本身性质,故错误;
⑧光是影响某些化学反应速率的外界条件之一,如氯气和氢气在光照条件下可发生反应,故正确.
故选A.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的学习和积累,难度不大.

练习册系列答案
相关题目
14.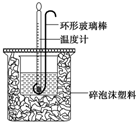 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
(1)碎泡沫塑料的作用是保温隔热,减少热量损失环形玻璃搅拌棒可不可以用铜丝搅拌棒代替,为什么不可以;铜的导热性好,易损失热量产生误差
(2)该实验测得的中和热数值为56.8 kJ•mol-1,(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算).
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值偏小(“偏大”、“偏小”或“不变”)
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
(2)该实验测得的中和热数值为56.8 kJ•mol-1,(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算).
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值偏小(“偏大”、“偏小”或“不变”)
5.设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 1mol/L 的Na2CO3溶液中,含有的Na+离子数为2 NA | |
| B. | 0.5 mol H2SO4含有的原子数目为3.5NA | |
| C. | 32 g O2所含的分子数目为NA | |
| D. | 27g金属铝变成铝离子时失去的电子数为3NA |
2.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行滴定操作:
选用仪器如下:①量筒;②锥形瓶;③滴定管;④玻璃棒.上列仪器中在使用前需检查是否漏水的是③.(填序号)除以上仪器外还缺的玻璃仪器有250mL容量瓶中、胶头滴管.
操作步骤:
A.在250mL容量瓶中配制250mL烧碱溶液
B.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
附:酸碱指示剂变色范围
请完成下列问题:
(1)正确的操作步骤是(填写字母)C→A→B→D→E.
(2)滴定管读数应注意滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数精确到0.01ml.
(3)操作中锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况.
(4)操作D中液面应调整到调节到零刻度或零稍下的某一刻度,充满标准H2SO4溶液;
(5)滴定到终点时锥形瓶内溶液的pH约为4;终点时的颜色变化是溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响偏高(填“偏高”、“偏低”或“无影响”,其他操作均正确).
选用仪器如下:①量筒;②锥形瓶;③滴定管;④玻璃棒.上列仪器中在使用前需检查是否漏水的是③.(填序号)除以上仪器外还缺的玻璃仪器有250mL容量瓶中、胶头滴管.
操作步骤:
A.在250mL容量瓶中配制250mL烧碱溶液
B.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
附:酸碱指示剂变色范围
| 指示剂 | 变色范围 | 酸色 | 碱色 |
| 石蕊 | 5.0-8.0 | 红色 | 蓝色 |
| 酚酞 | 8.0-10.0 | 无色 | 红色 |
| 甲基橙 | 3.1-4.4 | 红色 | 黄色 |
(1)正确的操作步骤是(填写字母)C→A→B→D→E.
(2)滴定管读数应注意滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数精确到0.01ml.
(3)操作中锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况.
(4)操作D中液面应调整到调节到零刻度或零稍下的某一刻度,充满标准H2SO4溶液;
(5)滴定到终点时锥形瓶内溶液的pH约为4;终点时的颜色变化是溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响偏高(填“偏高”、“偏低”或“无影响”,其他操作均正确).
9.常温下,某溶液中由水电离产生的c(OH-)、c(H+)满足c(OH-)•c(H+)=10-24,下列各组离子在溶液中可能大量共存的是( )
| A. | Mg2+、NO3-、K+、Cl- | B. | Fe2+、NO3-、Al3+、Cl- | ||
| C. | Mg2+、SO42-、Na+、HCO3- | D. | K+、NH4+、AlO2-、SO42- |
19.下列物质的分类正确的是( )
| A. | NO--酸性氧化物 | B. | 液氯--非电解质 | C. | 小苏打--酸式盐 | D. | 纯碱--碱 |
3.用铝制易拉罐手机满CO2后迅速加入过量浓NaOH溶液,立即把口封闭.发现易拉罐“咔咔”作响,并变瘪了,过一会儿后,易拉罐又会作响并鼓起来.下列说法正确的是( )
| A. | 导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| C. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 | |
| D. | 反应结束后,易拉罐内溶液中的溶质只有Na[Al(OH)4] |
4.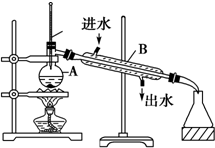 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
(1)图中有两处明显的错误是
①温度计水银球应位于蒸馏烧瓶的支管处;
②冷凝管中冷凝水应低进高出.
(2)阅读分析表格信息,回答问题:
将乙二醇和丙三醇相互分离的最佳方法是A(填序号).
A.蒸馏法 B.萃取法 C.过滤法 D.分液法.
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题(1)图中有两处明显的错误是
①温度计水银球应位于蒸馏烧瓶的支管处;
②冷凝管中冷凝水应低进高出.
| 物质 | 熔点/℃ | 沸点/℃ | 密度 /g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水 和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精 以任意比互溶 |
将乙二醇和丙三醇相互分离的最佳方法是A(填序号).
A.蒸馏法 B.萃取法 C.过滤法 D.分液法.
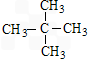 .
.