题目内容
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:则下列分析都正确的组合是:( )


| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)<c(HCO3-) |
| B | NaOH、Na2CO3 | Ⅳ | c(OH-)>c(CO32-) |
| C | Na2CO3 | Ⅲ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D | NaHCO3 | I | c(Na+)=c(HCO3-) |
| A、A | B、B | C、C | D、D |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:A、与氢氧化钠、碳酸钠反应消耗了2个单位的氯化氢,而碳酸氢钠与氯化氢反应消耗的氯化氢的物质的量应该小于两个单位;
B、Ⅳ图表示NaOH和Na2CO3的混合物;
C、Ⅲ图表示Na2CO3;
D、Ⅰ图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3.
B、Ⅳ图表示NaOH和Na2CO3的混合物;
C、Ⅲ图表示Na2CO3;
D、Ⅰ图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3.
解答:
解:向一定量NaOH溶液的烧杯中通入不同量的CO2气体,当二氧化碳少量时,产物是NaOH和Na2CO3的混合物,当NaOH和CO2恰好完全反应时,产物只有Na2CO3的,当二氧化碳过量时,产物可能只有NaHCO3,也可能是Na2CO3和NaHCO3的混合物.
A、从图中看出刚滴下去盐酸一个单位后产生了二氧化碳,说明此时碳酸根的量是一个单位(盐多酸少,碳酸钠和盐酸一比一反应生成碳酸氢钠),后来盐酸加了两个单位才把所有二氧化碳反应出来,说明溶液中总的碳酸氢根量为两个单位,但有一个单位的是之前碳酸根得来的,所以原溶液中碳酸根的量和碳酸氢根的量相等,即c(Na2CO3)=c(NaHCO3),故A错误;
B、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明产物是NaOH和Na2CO3的混合物,一个单位的盐酸和NaOH反应,第二个单位的盐酸和Na2CO3反应生成NaHCO3,后由图中可看出,NaHCO3又消耗了一个单位的盐酸,则含有氢氧化钠和碳酸钠的量之比是1:1,故B错误.
C、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,且产生二氧化碳所消耗的盐酸也是两个单位,说明产物只有Na2CO3,物料守恒可知:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);故C错误;
D、Ⅰ图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3,故c(Na+)=c(HCO3-),故D正确;
故选D.
A、从图中看出刚滴下去盐酸一个单位后产生了二氧化碳,说明此时碳酸根的量是一个单位(盐多酸少,碳酸钠和盐酸一比一反应生成碳酸氢钠),后来盐酸加了两个单位才把所有二氧化碳反应出来,说明溶液中总的碳酸氢根量为两个单位,但有一个单位的是之前碳酸根得来的,所以原溶液中碳酸根的量和碳酸氢根的量相等,即c(Na2CO3)=c(NaHCO3),故A错误;
B、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明产物是NaOH和Na2CO3的混合物,一个单位的盐酸和NaOH反应,第二个单位的盐酸和Na2CO3反应生成NaHCO3,后由图中可看出,NaHCO3又消耗了一个单位的盐酸,则含有氢氧化钠和碳酸钠的量之比是1:1,故B错误.
C、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,且产生二氧化碳所消耗的盐酸也是两个单位,说明产物只有Na2CO3,物料守恒可知:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);故C错误;
D、Ⅰ图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3,故c(Na+)=c(HCO3-),故D正确;
故选D.
点评:本题考查学生金属钠的化合物的性质,可根据碳酸钠、碳酸氢钠、氢氧化钠分别与盐酸反应的化学方程式来计算.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、苯的分子是环状结构,属于烷烃 |
B、 表示苯的分子结构,其中含有碳碳单键、双键 表示苯的分子结构,其中含有碳碳单键、双键 |
| C、苯的分子式为C6H6,分子中碳原子远远没有饱和,因此,能与溴水反应 |
| D、苯不使酸性高锰酸钾褪色,说明苯分子中不含碳碳双键 |
下列各组实验现象可用同一原理解释的是( )
| A、品红溶液中分别通入SO2和Cl2,品红均褪色 |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
| C、溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
| D、鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出 |
下列关于海水资源综合利用的说法中,正确的是( )
| A、只通过物理变化即可提取海水中的溴单质 |
| B、海水蒸发制海盐的过程只发生化学变化 |
| C、从海水中可以得到NaCl,可电解NaCl溶液制备Na |
| D、利用海水、铝、空气的航标灯是将化学能转化为电能 |
下列化学用语使用正确的是( )
A、F-离子的结构示意图: |
B、水分子的球棍模型: |
| C、HCN分子的结构式:H-C≡N |
D、二氧化碳的电子式 |
下列说法或表示方法正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、在101kPa时,2gH2完全燃料生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ?mol-1 |
| C、由C(石墨,s)=C(金刚石,s)△H=+1.90kJ/mol可知,金刚石比石墨稳定 |
| D、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol可知,若将含1molCH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ |
下列有关说法中,错误的是( )
| A、今夏,全国不少地区出现了严重的旱情,缓解旱情的措施之一是用碘化银进行人工增雨 |
| B、合金材料中可能含有非金属元素 |
| C、利用红外光谱仪能确定有机物的某些官能团 |
| D、人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
下列对某些问题的认识正确的是( )
| A、漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| B、SO32-、ClO-、NO3-三种酸根离子在溶液中能大量共存 |
| C、不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
| D、98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
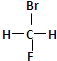 和
和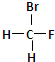 ②1H-、2H、3H+、D2 ③淀粉和纤维素 ④
②1H-、2H、3H+、D2 ③淀粉和纤维素 ④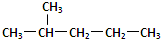 和
和 ⑤16O2、18O3 ⑥235U、238U
⑤16O2、18O3 ⑥235U、238U