题目内容
下列叙述正确的是( )
| A、工业上用电解熔融氯化钠的方法制取钠 |
| B、钠加入氯化镁的饱和溶液中可以制取金属镁 |
| C、电解冶炼铝的原料是氯化铝 |
| D、碳在高温下能还原氧化镁中的镁 |
考点:金属冶炼的一般原理
专题:元素及其化合物
分析:A.活泼金属采用电解熔融盐或氧化物的方法冶炼,钠属于活泼金属,工业上采用电解熔融氯化钠的方法冶炼;
B.将钠加入到氯化镁溶液中,钠先和水反应生成氢氧化钠,无法置换出金属镁;
C.氯化铝为共价化合物,熔融时无离子,通常采用电解氧化铝可以制金属铝;
D.金属镁是活泼金属,不能用采用热还原法冶炼,通常采用电解法来冶炼;
B.将钠加入到氯化镁溶液中,钠先和水反应生成氢氧化钠,无法置换出金属镁;
C.氯化铝为共价化合物,熔融时无离子,通常采用电解氧化铝可以制金属铝;
D.金属镁是活泼金属,不能用采用热还原法冶炼,通常采用电解法来冶炼;
解答:
解:活泼金属采用电解其熔融盐或氧化物的方法冶炼,如Na、Mg用电解其熔融盐的方法冶炼,铝采用电解氧化铝的方法冶炼,不活泼金属可以采用热分解方法冶炼.
A.钠是活泼金属,工业上采用电解法冶炼,2NaCl(熔融)
2Na+Cl2↑,故A正确;
B.将钠加入到氯化镁溶液中,钠先和水反应生成氢氧化钠,氢氧化钠再和氯化镁发生复分解所以生成氢氧化镁、氯化钠,所以得不到镁,钠、镁都是活泼金属,工业上采用电解其熔融盐的方法冶炼,故B错误;
C.铝是活泼金属,通常用电解的方法冶炼,氯化铝为共价化合物,熔融时无离子,工业上采用电解氧化铝的方法冶炼铝,故C错误;
D.镁能在CO2中燃烧生成碳和氧化镁,镁是活泼金属,通常用电解的方法冶炼,故D错误;
故选A.
A.钠是活泼金属,工业上采用电解法冶炼,2NaCl(熔融)
| ||
B.将钠加入到氯化镁溶液中,钠先和水反应生成氢氧化钠,氢氧化钠再和氯化镁发生复分解所以生成氢氧化镁、氯化钠,所以得不到镁,钠、镁都是活泼金属,工业上采用电解其熔融盐的方法冶炼,故B错误;
C.铝是活泼金属,通常用电解的方法冶炼,氯化铝为共价化合物,熔融时无离子,工业上采用电解氧化铝的方法冶炼铝,故C错误;
D.镁能在CO2中燃烧生成碳和氧化镁,镁是活泼金属,通常用电解的方法冶炼,故D错误;
故选A.
点评:本题考查了金属的冶炼方法,根据金属的活泼性来选取相应的冶炼方法,注意:氯化铝是分子晶体,所以不能用电解氯化铝的方法冶炼铝,为易错点,题目难度不大.

练习册系列答案
相关题目
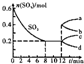 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )| A、用O2表示0~8 min内该反应的平均速率为0.025 mol?(L?min)-1 |
| B、升高温度,达到新平衡时的化学平衡常数比原平衡的小 |
| C、容器内压强保持不变时反应处于平衡状态 |
| D、第12min时,容器压强到1L,则SO3的变化曲线为a |
下列有关物质的保存方法,不正确的是( )
| A、液氯储存在钢瓶中 |
| B、浓硫酸储存在铝制容器中 |
| C、金属钠保存在煤油中 |
| D、氢氧化钠溶液保存在带玻璃塞的玻璃试剂瓶中 |
有机物 的系统命名正确的是( )
的系统命名正确的是( )
 的系统命名正确的是( )
的系统命名正确的是( )| A、2,4,4-三甲基己烷 |
| B、2,4-二甲基-2-乙基戊烷 |
| C、3,3,5-三甲基已烷 |
| D、2,4-二甲基-4-乙基戊烷 |
下列物质的分子中,属于正四面体结构的是( )
| A、CHCl3 |
| B、CH4 |
| C、CH2Cl2 |
| D、CH3Cl |
酸雨的形成主要是由于( )
| A、森林遭到乱砍滥伐,破坏了生态环境 |
| B、含硫化石燃料的大量燃烧 |
| C、大气中二氧化碳的含量增大 |
| D、汽车排出大量尾气 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| B、1 mol?L-1的碳酸钠溶液中含有CO32-的数目小于NA |
| C、标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
| D、1molNa被完全氧化生成Na2O2,失去个2 NA电子 |
下列有关反应的离子方程式书写正确的是( )
| A、钠与水反应:2Na+2H2O═2OH-+2Na++H2↑ |
| B、用氢氧化钡溶液中和稀硫酸:2H++2OH-═2H2O |
| C、向氯化铁溶液中加入铁钉:Fe3++Fe═2Fe2+ |
| D、用石灰石与稀盐酸制取二氧化碳:CO32-+2H+═CO2↑+H2O |
 氯气是重要的化工原料.
氯气是重要的化工原料.