题目内容
TDI、MDI等精细化工使用的H2可以通过天然气来制取,其生产流程如图1:
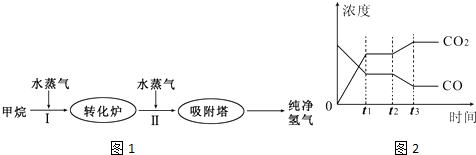
(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),100℃时,将1mol CH4和2mol H2O(g)通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K= .
(2)此流程的第II步反应:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
从上表可以推断:该反应是 反应(填“吸热”或“放热”).若该反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol/L,反应达到平衡时,CO的转化率为 .如图2表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,如图2中t2时刻发生改变的条件是 (写出一种).

(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),100℃时,将1mol CH4和2mol H2O(g)通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=
(2)此流程的第II步反应:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
考点:化学平衡常数的含义,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)100℃时,将1mol CH4和2mol H2O(g)通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5,则转化的n(CH4)=1mol×0.5=0.5mol,平衡时c(CH4)=
=0.005mol/L,c(H2O)=
=0.015mol/L,c(CO)=
=0.005mol/L,C(H2)=
=0.015mol/L,化学平衡常数K=
;
(2)升高温度平衡向吸热反应方向移动,根据温度与化学平衡常数关系确定反应热;
根据化学平衡计算计算CO的转化率;在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,可以通过改变温度、改变水蒸气或氢气的量实现.
| 1mol×(1-0.5) |
| 100L |
| 2mol-0.5mol |
| 100L |
| 1mol×0.5 |
| 100L |
| 1mol×0.5×3 |
| 100L |
| c(CO).c3(H2) |
| c(CH4).c(H2O) |
(2)升高温度平衡向吸热反应方向移动,根据温度与化学平衡常数关系确定反应热;
根据化学平衡计算计算CO的转化率;在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,可以通过改变温度、改变水蒸气或氢气的量实现.
解答:
解:(1)100℃时,将1mol CH4和2mol H2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 0.01 0.02 0 0
变化量(mol/L) 0.005 0.005 0.005 0.015
平衡量(mol/L) 0.005 0.015 0.005 0.015
化学平衡常数K=
=
=2.25×10-4 ,故答案为:2.25×10-4 ;
(2)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;
设CO的转化率为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始0.02mol/L 0.02mol/L 0 0
反应0.02xmol/L 0.02xmol/L 0.02xmol/L 0.02xmol/L
平衡0.02(1-x)mol/L0.02(1-x)mol/L 0.02xmol/L 0.02xmol/L
化学平衡常数K=
=9,x=75%;
在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现,
故答案为:放热;75%;降低温度或增加水蒸气的量或减少氢气的量.
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 0.01 0.02 0 0
变化量(mol/L) 0.005 0.005 0.005 0.015
平衡量(mol/L) 0.005 0.015 0.005 0.015
化学平衡常数K=
| c(CO).c3(H2) |
| c(CH4).c(H2O) |
| 0.005×(0.015)3 |
| 0.005×0.015 |
(2)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;
设CO的转化率为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始0.02mol/L 0.02mol/L 0 0
反应0.02xmol/L 0.02xmol/L 0.02xmol/L 0.02xmol/L
平衡0.02(1-x)mol/L0.02(1-x)mol/L 0.02xmol/L 0.02xmol/L
化学平衡常数K=
| 0.02x×0.02x |
| [0.02×(1-x)]2 |
在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现,
故答案为:放热;75%;降低温度或增加水蒸气的量或减少氢气的量.
点评:本题考查了化学平衡移动原理,明确化学平衡常数的含义结合化学平衡常数公式进行有关计算,灵活运用三段式法进行解答,会分析图象中曲线变化特点,题目难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4═2ClO2+2NaHSO4,下列说法正确的是( )
| A、ClO2在反应中是氧化产物 |
| B、NaClO3在反应中失去电子 |
| C、H2SO4在反应中作氧化剂 |
| D、1mol氧化剂在反应中得到1mol电子 |
下列各选项中,后者不属于前者的是( )
| A、酸、硫酸 |
| B、碱、纯碱 |
| C、化合物、氧化物 |
| D、碳酸盐、Na2CO3 |
下列装置或操作能达到有关实验目的是( )
A、 能收集O2、CO2,但不能收集H2 |
B、 可制备并收集少量NO2气体 |
C、 用于分离出溴苯 |
D、 用于将海带灼烧成灰 |
