题目内容
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、足量Fe在1molCl2中充分燃烧,转移3NA个电子 |
| B、7.8gNa2O2中阴、阳离子总数为0.3NA |
| C、Cl2+H2O?HCl+HClO,若1molCl2参与反应,则转移NA个电子 |
| D、反应KClO3+6HCl═KCl+3Cl2+3H2O中,若有1molH2O生成,转移电子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.铁与氯气反应生成氯化铁,1mol氯气完全反应得到2mol电子;
B.过氧化钠中阴离子为过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子;
C.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;
D.氯酸钾中氯元素被氧化成0价的氯气,生成3mol水转移了5mol电子,据此计算出生成1mol水转移的电子数.
B.过氧化钠中阴离子为过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子;
C.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;
D.氯酸钾中氯元素被氧化成0价的氯气,生成3mol水转移了5mol电子,据此计算出生成1mol水转移的电子数.
解答:
解:A.1mol氯气与足量铁反应最多得到2mol电子,转移的电子数为2NA,故A错误;
B.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol电子,阴、阳离子总数为0.3NA,故B正确;
C.氯气与水的反应为可逆反应,1mol氯气与水反应,反应消耗的氯气小于1mol,转移的电子小于1mol,转移的电子小于NA,故C错误;
D.反应KClO3+6HCl═KCl+3Cl2+3H2O中,氯元素化合价向中间靠拢,氯酸钾中+5价Cl元素被还原成0价,化合价降低5价,若有1molH2O生成,转移的电子为:
×5=
mol,转移电子数为
NA,故D错误;
故选B.
B.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol电子,阴、阳离子总数为0.3NA,故B正确;
C.氯气与水的反应为可逆反应,1mol氯气与水反应,反应消耗的氯气小于1mol,转移的电子小于1mol,转移的电子小于NA,故C错误;
D.反应KClO3+6HCl═KCl+3Cl2+3H2O中,氯元素化合价向中间靠拢,氯酸钾中+5价Cl元素被还原成0价,化合价降低5价,若有1molH2O生成,转移的电子为:
| 1mol |
| 3 |
| 5 |
| 3 |
| 5 |
| 3 |
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确过氧化钠中阴离子为过氧根离子,选项D为易错点,注意该氧化还原反应中氯元素的化合价变化情况.

练习册系列答案
相关题目
下列物质中,在题中所给状态下能够导电的电解质是( )
| A、铜丝 | B、熔融的氯化镁 |
| C、氯化钠固体 | D、蔗糖溶液 |
下列离子方程式正确的是( )
| A、Ba(OH)2溶液中滴入足量的NaHCO3溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O |
| B、Ba(OH)2溶液中滴入CuSO4溶液:2OH-+Cu2+═Cu(OH)2↓ |
| C、盐酸和澄清的石灰水混合:H++OH-═H2O |
| D、Cu与浓硫酸反应:Cu+4H++SO42-═Cu2++SO2↑+2H2O |
只需用一种试剂即可将酒精、四氯化碳、己烯、甲苯四种无色液体区分开来,该试剂是( )
| A、FeCl3溶液 |
| B、溴水 |
| C、稀盐酸 |
| D、金属钠 |
在体积为100ml的密闭容器中,放入反应物A和B,在不同的温度下发生反应:2A(s)+B(g)?2C(g),得到该反应平衡常数与温度的关系如表所示.
下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、加热平衡向右移动 |
| B、25℃时反应2C?2A(s)+B(g)的平衡常数为0.5 |
| C、在80℃时,测得某时刻,B、C浓度均为0.5mol/L,则此时v(正)>v(逆) |
| D、80℃达到平衡时,再投入一定量的A,平衡正向移动 |
试管里有一黑色粉末状固体,加热后有红色固体生成,同时还生成一种无色无味且能使澄清石灰水变浑浊的气体.此固体物质可能是( )
| A、氧化铜和木炭粉的混合物 |
| B、氧化铁和木炭粉的混合物 |
| C、木炭粉 |
| D、氧化铜和二氧化锰的混合物 |
不能用化学平衡移动原理来说明的事实是( )
| A、合成氨在高压下进行是有利的 |
| B、温度过高对合成氨不利 |
| C、使用催化剂能使合成氨速率加快 |
| D、及时分离从合成塔中出来的混合气,有利于合成氨 |
某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是( )
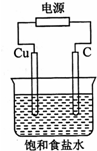

| A、石墨电极与直流电源负极相连 |
| B、用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
| C、氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 |
| D、铜电极的反应式为:2H++2e-═H2↑ |