题目内容
某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量,体积均为1L),当闭合该装置的开关K时,观察到电流计的指针发生了偏转.

请回答下列问题:
(1)甲、乙、丙三池中为原电池的是 (填“甲池”“乙池”或“丙池”).
(2)丙池中F电极为 (填“正极”“负极”“阴极”或“阳极”),该池的总反应式为 .
(3)当乙池中C电极质量减轻10.8g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况),则丙池溶液的PH为.
(4)一段时间后,断开开关K.下列物质能使丙池恢复到反应前浓度的是 (填选项字母).
A.Cu B.CuO C.CuCO3 D.Cu2(OH)2 CO3.

请回答下列问题:
(1)甲、乙、丙三池中为原电池的是
(2)丙池中F电极为
(3)当乙池中C电极质量减轻10.8g时,甲池中B电极理论上消耗O2的体积为
(4)一段时间后,断开开关K.下列物质能使丙池恢复到反应前浓度的是
A.Cu B.CuO C.CuCO3 D.Cu2(OH)2 CO3.
考点:原电池和电解池的工作原理
专题:
分析:(1)根据燃料电池的工作原理和原电池的形成条件回答;
(2)根据电解池阴极阳极的判断方法以及电解池的工作原理来回答;
(3)根据电子守恒来计算回答;
(4)根据溶液复原的方法:出什么加什么来回答.
(2)根据电解池阴极阳极的判断方法以及电解池的工作原理来回答;
(3)根据电子守恒来计算回答;
(4)根据溶液复原的方法:出什么加什么来回答.
解答:
解:(1)乙池Ag和硝酸铜溶液不反应,丙池无活性电极,甲池是燃料电池,属于原电池,在该燃料电池中,负极上是甲醇发生失电子的氧化反应,在碱性环境下,CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:甲池;
(2)甲池中,通入甲醇的电极是负极,通入氧气的电极是正极,所以F是阴极,E是阳极,D是阴极,C是阳极,电解硫酸铜溶液的电极反应式为:2CuSO4+2H2O
2H2SO4+2Cu+O2↑,故答案为:阴极;2CuSO4+2H2O
2H2SO4+2Cu+O2↑;
(3)C极上的电极反应为:Ag-e-=Ag+,B电极上的电极反应为:O2+2H2O+4e-=4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.25mol,体积为0.25mol×22.4L/mol=0.56L=560mL,故答案为:560;
④丙池用惰性电极电解硫酸铜溶液,在阴极上是铜离子得电子生成金属铜的反应,阳极上氢氧根离子失电子生成氧气,溶液中减少了Cu和O元素的质量,所以要让电解质复原,需要加入CuO或CuCO3,加入Cu2(OH)2 CO3时,会增大水的量,故选BC.
故答案为:甲池;
(2)甲池中,通入甲醇的电极是负极,通入氧气的电极是正极,所以F是阴极,E是阳极,D是阴极,C是阳极,电解硫酸铜溶液的电极反应式为:2CuSO4+2H2O
| ||
| ||
(3)C极上的电极反应为:Ag-e-=Ag+,B电极上的电极反应为:O2+2H2O+4e-=4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.25mol,体积为0.25mol×22.4L/mol=0.56L=560mL,故答案为:560;
④丙池用惰性电极电解硫酸铜溶液,在阴极上是铜离子得电子生成金属铜的反应,阳极上氢氧根离子失电子生成氧气,溶液中减少了Cu和O元素的质量,所以要让电解质复原,需要加入CuO或CuCO3,加入Cu2(OH)2 CO3时,会增大水的量,故选BC.
点评:本题考查了原电池电解池的相互串联问题,注意首先区分原电池和电解池,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
下列说法正确的是( )
| A、工业生产玻璃、水泥、陶瓷都要使用石灰石做原料 |
| B、开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径 |
| C、“把世博会期间产生的垃圾焚烧或深埋处理”方案符合上海世博会实现“环保世博、生态世博”的目标 |
| D、光化学烟雾、臭氧层空洞、温室效应、硝酸型酸雨的形成都与氮氧化合物有关 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+.Ag+.Na+.Cl- |
| B、K+.Na+.NO3-.CO32- |
| C、Na+.H+.NO3-.SO42- |
| D、Fe3+.Na+.Cl-. SO42- |
已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+Sn2++2Fe3+=2Fe2++Sn4+下列说法正确的是( )
| A、还原性:Sn2+>Fe2+>Ce3+ |
| B、还原性:Fe2+>Ce3>+Sn2+ |
| C、氧化性:Sn4+>Ce4>+Fe3+ |
| D、氧化性:Ce4>+Fe3+>Sn4+ |
下列物质中,前者属于电解质,后者属于非电解质的是( )
| A、CO2 蔗糖 |
| B、SO3 H2SO4 |
| C、盐酸 NaCl |
| D、CaCO3 酒精 |
标准状况下,11.2g某气体的分子数与22gCO2的分子数相等,则该气体的密度是( )
| A、1g/L | B、1.5g/L |
| C、2g/L | D、3g/L |
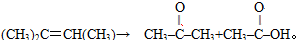 现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和
现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和 请写出该烯烃分子发生加聚反应的化学方程式
请写出该烯烃分子发生加聚反应的化学方程式