题目内容
11.图为冰晶体的结构模型,大球代表O原子,小球代表H原子,下列有关说法正确的是( )
| A. | 冰晶体中每个水分子与另外2个水分子形成四面体 | |
| B. | 冰晶体具有空间网状结构,是原子晶体 | |
| C. | 水分子间通过H-O…H键形成冰晶体 | |
| D. | 冰晶体熔化时,水分子之间的空隙增大 |
分析 在冰晶体中分子之间是通过氢键作用,是分子晶体,在每个水分子中氧原子按sp3方式杂化,每个水分子都可以与另外四个水分子形成氢键,而氢键具有方向性和饱和性,据此答题.
解答 解:在冰晶体中分子之间是通过氢键作用,是分子晶体,在每个水分子中氧原子按sp3方式杂化,每个水分子都可以与另外四个水分子形成氢键,而氢键具有方向性和饱和性,
A、水分子中氧原子按sp3方式杂化,每个水分子都可以与另外四个水分子形成氢键,而氢键具有方向性,所以每个水分子与另外四个水分子形成四面体,故A错误;
B、冰晶体虽然具有空间网状结构,但分子之间是氢键,所以是分子晶体,故B错误;
C、水分子之间是通过氢键作用的,故C正确;
D、由于氢键有方向性,分子之间的空隙较大,当晶体熔化时,氢键被破坏,水分子之间的空隙减小,故D错误;
故选C.
点评 本题主要考查了氢键的相关知识,较容易,解题关键是对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.生产、生活中离不开化学知识.下列说法正确的是( )
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
19.下列有关命名的说法正确的是( )
| A. | 按系统命名法,有机物 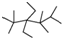 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 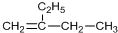 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
6.下列离子反应方程式不正确的是( )
| A. | 向Ca(ClO)2溶液中通入少量SO2Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 向NH4HCO3溶液中加入足量NaAlO2溶液:NH4++2AlO2-+HCO3--+2H2O═NH3↑+2Al(OH)3↓+CO32-. |
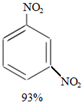
16. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
制备硝基苯的过程如下:
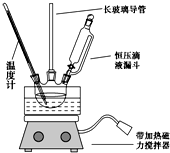
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O
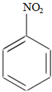 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+ +
+
(2)可能用到的有关数据列表如下
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.制备硝基苯的过程如下:
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+ +
+
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃) | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸[来] | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.

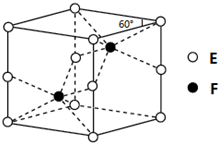 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题: