题目内容
3.将2molA和1molB充入VL的密闭容器中,在一定条件下发生反应:2A(g)+B(g)?2C(g).平衡时C的体积分数(%)随温度和压强的变化如表所示:| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 350 | 54.0 | a | b |
| 415 | c | 40.0 | d |
| 550 | e | f | 36.0 |
| A. | b>e | B. | 415℃、2.0MPa时B的转化率为60% | ||
| C. | 该反应的△H>0 | D. | 平衡常数K(550℃)>K(350℃) |
分析 A.该反应是气体体积减小的反应,加压平衡右移,C的体积分数增加,则b>54.0%,e<36.0%,据此可知b、e的大小;
B.在一定条件下发生反应2A(g)+B(g)?2C(g)
起始物质的量(mol) 2 1 0
转化物质的量(mol) 2x x 2x
平衡物质的量(mol) 2-2x x 2x
根据C的体积分数为40%,列式计算出x,然后计算出B的转化率;
C.该反应为气体体积缩小的反应,根据温度为415℃时c的压强较小,则c<40%,然后根据都是1.0MPa,350℃和415℃,温度升高而C的体积分数减小,据此可知还反应的焓变;
D.根据C可知该反应为放热反应,然后根据升高温度平衡移动方向判断两个不同温度下的平衡常数大小.
解答 解:A.该反应是气体体积减小的反应,加压平衡右移,C的体积分数增加,则b>54.0%,e<36.0%,所以b>e,A正确;
B.在一定条件下发生反应2A(g)+B(g)?2C(g)
起始物质的量(mol) 2 1 0
转化物质的量(mol) 2x x 2x
平衡物质的量(mol) 2-2x x 2x
C的体积分数为40%,则:$\frac{2x}{2-2x+x+2x}$×100%=40%,解得:x=0.5mol,所以B的转化率为:$\frac{0.5mol}{1mol}$×100%=50%,故B错误;
C.该反应为气体体积缩小的反应,根据温度为415℃时c的压强较小,则c<40%,然后根据都是1.0MPa,350℃和415℃,温度升高而C的体积分数减小,则该反应为放热反应,该反应的△H<0,故C错误;
D.该反应为放热反应,升温平衡左移,平衡常数减小,则K(550℃)<K(350℃),故D错误;
故选A.
点评 本题考查化学反应平衡移动及计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

 优生乐园系列答案
优生乐园系列答案| A. | 碳酸氢钠与醋酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | 等物质的量的硫酸氢钠与氢氧化钡溶液:SO42-+H++Ba2++OH-═H2O+BaSO4↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 金属钠与H2O 反应:Na+H2O═Na++OH-+H2↑ |
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
| A. | NaCl溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | 澄清石灰水 |
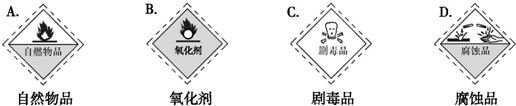
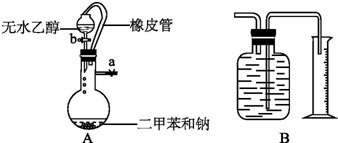
 研究NO2、SO2.CO等大气污染气体的处理具有重要意义.
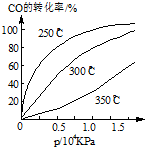
研究NO2、SO2.CO等大气污染气体的处理具有重要意义.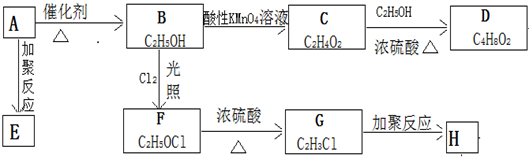
 ; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.