题目内容
向0.1mol/L的NaOH溶液中慢慢滴加同浓度的醋酸溶液,离子浓度之间的关系不可能出
现的是
- A.c(CH3COO-)>c(H+) = c(Na+)>c(OH-)
- B.c(Na+)>c(OH-) >c(CH3COO-)>c(H+)
- C.c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
- D.c(Na+) >c(CH3COO-)>c(OH-) >c(H+)
C
答案:C(有问题,应无选项符合题意)
原溶液中是Na+和 OH―,由电荷守恒c(OH-)=c(Na+)+c(H+),c(OH-)>c(Na+)>c(H+)随醋酸的加入,c(CH3COO-)不断增大,c(OH-)不断减小,最初出现C选项,c(OH-)>c(Na+)>c(H+)>c(CH3COO-),进而变成B选项,B.c(Na+)>c(OH-) >c(CH3COO-)>c(H+),再加醋酸,D.c(Na+) >c(CH3COO-)>c(OH-) >c(H+),到恰好完全反应时,NaOH与醋酸的物质的量相同时,c(Na+)+c(H+)=c(OH-) +c(CH3COO-),随醋酸加入出现中性,c(Na+)=c(CH3COO-)>c(H+)=c(OH-),再加醋酸,出现c(CH3COO-)> c(Na+)>c(H+)>c(OH-),随醋酸加入出现A.c(CH3COO-)>c(H+) = c(Na+)>c(OH-),醋酸过量后出现,c(CH3COO-)>c(H+) > c(Na+)>c(OH-),故原题无符合题意的选项。
答案:C(有问题,应无选项符合题意)
原溶液中是Na+和 OH―,由电荷守恒c(OH-)=c(Na+)+c(H+),c(OH-)>c(Na+)>c(H+)随醋酸的加入,c(CH3COO-)不断增大,c(OH-)不断减小,最初出现C选项,c(OH-)>c(Na+)>c(H+)>c(CH3COO-),进而变成B选项,B.c(Na+)>c(OH-) >c(CH3COO-)>c(H+),再加醋酸,D.c(Na+) >c(CH3COO-)>c(OH-) >c(H+),到恰好完全反应时,NaOH与醋酸的物质的量相同时,c(Na+)+c(H+)=c(OH-) +c(CH3COO-),随醋酸加入出现中性,c(Na+)=c(CH3COO-)>c(H+)=c(OH-),再加醋酸,出现c(CH3COO-)> c(Na+)>c(H+)>c(OH-),随醋酸加入出现A.c(CH3COO-)>c(H+) = c(Na+)>c(OH-),醋酸过量后出现,c(CH3COO-)>c(H+) > c(Na+)>c(OH-),故原题无符合题意的选项。

练习册系列答案
相关题目

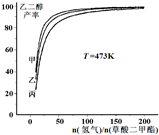 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=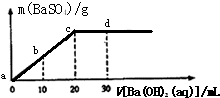 常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )