题目内容
1.有9种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙炔;⑧环己烯;⑨聚氯乙烯,其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )| A. | ①②③⑤ | B. | ①④⑥⑧ | C. | ①④⑥⑨ | D. | ①④⑤⑦ |
分析 含碳碳双键、三键的有机物与高锰酸钾、溴水均反应,苯的同系物能被高锰酸钾氧化,而烷烃、苯、聚氯乙烯与高锰酸钾、溴水均不反应,以此来解答.
解答 解:②乙烯、③乙炔、⑦聚乙炔、⑧环己烯均能使酸性KMnO4溶液褪色,也能与溴水反应使溴水褪色;
⑤甲苯只能高锰酸钾溶液褪色;
①乙烷、④苯、⑥溴乙烷、⑨聚氯乙烯既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
4.高铁酸钾(K2FeO4)是一种集氧化,吸附,絮凝于一体的新型多功能水处理剂,高铁酸盐热 稳定性差.制备方法有湿法、干法两种,其原理如下表所示:
湿法的生产工艺如图:

回答下列问题:
(1)K2FeO4 中 Fe 的化合价+6;实验室干法制备中选用的仪器是 B
A.蒸发皿 B.铁坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)在温度较高时 KOH 与 Cl2 反应生成的是 KClO3,写出在温度较高时 KOH 与 Cl2反应的化学方程式6KOH+3Cl2$\frac{\underline{\;高温\;}}{\;}$KClO3+5KCl+3H2O
(3)在溶液 I 中加入 KOH 固体的目的是 BD
A.使 KClO3 转化为 KClO
B.为下一步反应提供碱性的环境
C.KOH 固体溶解放热,有利于提高反应速率
D.与溶液 I 中过量的 Cl2 继续反应,生成更多的 KClO
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:
①Fe3++3OH+═Fe(OH)3
②3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(5)用异丙醇代替蒸馏水洗涤湿产品,除能洗去杂质外,其优点有减少K2FeO4晶体洗涤时产品的损失且产品易干燥.
(6)如何判断 K2FeO4 晶体已经洗涤干净取少量最后一次的洗涤液于试管中,加入硝酸银溶液,无白色沉淀则已被洗净.
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是能除去悬浮杂质,配平该反应的离子方程式:
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

回答下列问题:
(1)K2FeO4 中 Fe 的化合价+6;实验室干法制备中选用的仪器是 B
A.蒸发皿 B.铁坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)在温度较高时 KOH 与 Cl2 反应生成的是 KClO3,写出在温度较高时 KOH 与 Cl2反应的化学方程式6KOH+3Cl2$\frac{\underline{\;高温\;}}{\;}$KClO3+5KCl+3H2O
(3)在溶液 I 中加入 KOH 固体的目的是 BD
A.使 KClO3 转化为 KClO
B.为下一步反应提供碱性的环境
C.KOH 固体溶解放热,有利于提高反应速率
D.与溶液 I 中过量的 Cl2 继续反应,生成更多的 KClO
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:
①Fe3++3OH+═Fe(OH)3
②3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(5)用异丙醇代替蒸馏水洗涤湿产品,除能洗去杂质外,其优点有减少K2FeO4晶体洗涤时产品的损失且产品易干燥.
(6)如何判断 K2FeO4 晶体已经洗涤干净取少量最后一次的洗涤液于试管中,加入硝酸银溶液,无白色沉淀则已被洗净.
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是能除去悬浮杂质,配平该反应的离子方程式:
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
12.某有机物叫苯酚,其试剂瓶上有如下两种标识,由此推测该物质可能具有的性质是( )
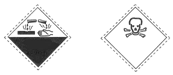

| A. | 腐蚀性、有毒 | B. | 自燃物品、易燃 | C. | 爆炸性、腐蚀性 | D. | 氧化剂、有毒 |
9.下列对如图两烧杯溶液分析一定正确的是( )
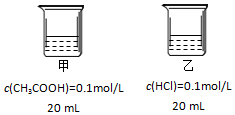

| A. | 甲、乙两烧杯中水电离出的H+浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件下,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向甲烧杯加入NaOH使溶液中性后一定存在:c(Na+)=c(CH3COO-)+c(CH3COOH) |
16.下列不能用于判断F 和 Cl的非金属性强弱的事实是( )
| A. | 气态氢化物的稳定性 | B. | 最高价氧化物对应的水化物的酸性 | ||
| C. | 单质与氢气反应的难易 | D. | F-和Cl-的还原性 |
6.在容积不变的密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
①平衡不发生移动; ②平衡向正反应方向移动;③平衡向逆反应方向移动;④NH3的质量分数增加;⑤正逆反应速率都增大.
①平衡不发生移动; ②平衡向正反应方向移动;③平衡向逆反应方向移动;④NH3的质量分数增加;⑤正逆反应速率都增大.
| A. | ①⑤ | B. | ③④ | C. | ②④ | D. | ②④⑤ |
13.下列叙述正确的是( )
| A. | 1 mol CO2 的质量为44g/mol | |
| B. | CO2的摩尔质量为44g | |
| C. | 1 mol CO2的质量与CO2的相对分子质量在数值上相同 | |
| D. | CO2的摩尔质量等于CO2的相对分子质量 |
10.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | Al2O3熔点高,可用于制作耐高温仪器 | |
| B. | 明矾净水与胶体的性质有关 | |
| C. | “滴水石穿,绳锯不断”不包含化学变化 | |
| D. | “火树银花不夜天”与金属的焰色反应有关 |
11.化学与环境密切相关,下列有关说法错误的是( )
| A. | NO2、NO含氮氧化物是光化学烟雾的主要污染物 | |
| B. | 酸性物质的排放加以控制,开发新清洁能源是减少酸雨的有效措施 | |
| C. | CO2、NO2或SO2都会导致酸雨的形成 | |
| D. | 大气中CO2含量的增加会导致温室效应加剧 |