题目内容
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
[ ]
A.12N2H4(g)+12O2(g)===12N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
D

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
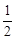 N2H4(g)+
N2H4(g)+